Tertiær alkoholstruktur, egenskaper, eksempler
- 2442
- 646
- Markus Fredriksen
EN Tertiær alkohol Det er en der hydroksylgruppen, oh, er knyttet til et tertiært karbon. Formelen fortsetter å være ROH, som andre alkoholer; Men det gjenkjennes lett fordi OH er nær en X i molekylstrukturen. Dessuten er den kullsyreholdige kjeden vanligvis kortere, og dens viktigste molekylmasse.
Deretter har en tertiær alkohol en tendens til å være tyngre, den er mer forgrenet, og den er også den minst reaktive med hensyn til oksidasjon; det vil si at det ikke kan transformeres til en keton eller karboksylsyre som forekommer med henholdsvis sekundære og primære alkoholer.
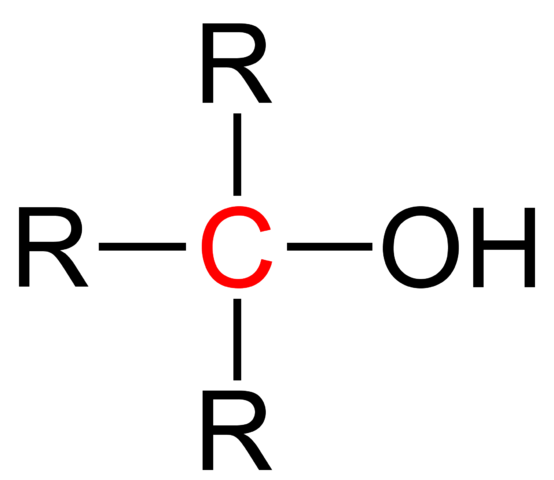
 Strukturell formel av en tertiær alkohol. Kilde: Jü [Public Domain].
Strukturell formel av en tertiær alkohol. Kilde: Jü [Public Domain]. Den generelle strukturelle formelen for en tertiær alkohol vises i det øvre bildet. I følge henne kan det skrives en ny R -type formel3COH, der R kan være en alkyl- eller arylgruppe; En metilogruppe, CH3, eller en kort eller lang kullsyreholdig kjede.
Hvis de tre R -gruppene er forskjellige, vil det sentrale karbonet for tertiær alkohol være chiral; det vil si at alkohol vil presentere optisk aktivitet. For dette faktum belaster de tertiære quirale alkoholer interessen innen legemiddelindustrien, siden fra ketoner med biologisk aktivitet syntetiseres disse med mer komplekse strukturer.
[TOC]
Struktur av en tertiær alkohol
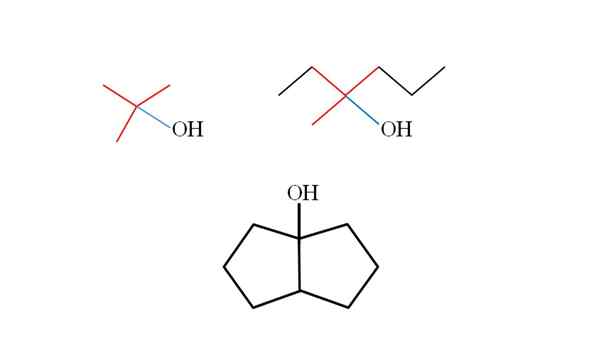 Tre tertiære alkoholer og deres strukturer. Kilde: Gabriel Bolívar.
Tre tertiære alkoholer og deres strukturer. Kilde: Gabriel Bolívar. Tenk på strukturene til de øvre tertiære alkoholer for å lære å gjenkjenne dem uavhengig av forbindelsen. Karbonet knyttet til OH må også være knyttet til tre andre karbonatomer. Hvis det blir observert i detalj, overholder de tre alkoholene dette.
Den første alkoholen (til venstre), består av tre grupper CH3 Sentral karbonkoblet, hvis formel ville være (Cho3)3COH. Leiegruppen (velg3)3C- Det er kjent som tertbutil.
Det kan tjene deg: Potentiometer (phameter)Den andre alkoholen (til høyre), har den sentrale karbonlin3, Ch3Ch2 og Ch2Ch2Ch3. Ettersom de tre gruppene er forskjellige, er alkohol chiral og viser derfor optisk aktivitet. En T blir ikke observert her, men en X nær OH (rød og blå).
Og i den tredje alkoholen (nedenfor og uten farger) er OH knyttet til en av de to karbonatomer som blir med to Cyclopentano. Denne alkoholen presenterer ikke optisk aktivitet fordi to av de sentrale karbonkoblede gruppene er identiske. Som den andre alkoholen, hvis den blir nøye observert, vil en X (snarere en tetrahedron) også bli funnet.
Sterisk hindring
De tre overordnede alkoholer har noe mer til felles enn en X: sentralt karbon forhindres sterisk; det vil si at det er mange atomer som omgir ham i verdensrommet. En umiddelbar konsekvens av dette er at nukleofiler, ivrige etter positive ladninger, får vanskeligheter med å nærme seg dette karbonet.
På den annen side, med tre karbon knyttet til det sentrale karbonet, donerer de en del av den elektroniske tettheten som det elektronegative atomet i oksygen trekker det, og stabiliserer det enda mer foran disse nukleofile angrepene. Imidlertid kan tertiær alkohol lide substitusjon ved å danne karbokasjon.
Egenskaper
Fysisk
De tredje alkoholene presenterer generelt høyt forgrenede strukturer. En første konsekvens av dette er at OH -gruppen forhindres, og derfor utøver dipolmomentet en mindre effekt på nabomolekyler.
Dette oversettes til svakere molekylære interaksjoner sammenlignet med primære og sekundære alkoholer.
Kan tjene deg: Le Châtelier -prinsippetTenk for eksempel på de strukturelle isomerer av butanol:
Ch3Ch2Ch2Åh (n-Butanol, PEB = 117 ºC)
(Ch3)2Ch2OH (Isobutilical alkohol, PEB = 107 ºC)
Ch3Ch2CH (OH) CH3 (Secbutilicalkohol, PEB = 98 ºC)
(Ch3)3COH (Tertbutilical alkohol, PEB = 82 ºC)
Legg merke til hvordan kokepunkter går ned når isomeren blir mer forgrenet.
Til å begynne med ble det nevnt at i strukturene til alkoholer 3 blir en X observert, noe som i seg selv indikerer en høy gren. Det er grunnen til at disse alkoholene har en tendens til å ha lavere smelting og/eller kokepunkter.
Litt lik er tilfelle for din blandbarhet med vann. Jo mer forhindret, desto mindre blandbar vil være alkohol 3 med vann. Imidlertid reduserer denne blandbarheten jo lenger karbonkjeden; Dermed er termisk alkohol mer løselig og blandbar med vann enn n-Butanol.
Surhet
Tertiære alkoholer har en tendens til å være minst mulig syrer av alle. Årsakene er mange og forholder seg til hverandre. Oppsummert kontoer er den negative belastningen på dets avledede alcoxide, rød-, Du vil føle en sterk frastøtning for de tre alkalgruppene knyttet til det sentrale karbonet, og svekker anionen.
Jo mer ustabil anion, jo mindre vil surheten i alkohol være.
Reaktivitet
3. alkoholer kan ikke lide oksidasjoner til ketoner (r2C = O) eller aldehydos (RCHO) eller karboksylsyrer (RCOOH). På den ene siden må jeg miste en eller to karbonatomer (i form av CO2) å oksidere, noe som reduserer dens reaktivitet mot oksidasjon; Og på den annen side mangler det hydrogen som kan tape for å danne en annen kobling med oksygen.
Det kan tjene deg: pyridin: struktur, egenskaper, bruk, toksisitet, synteseImidlertid kan de lide substitusjon og eliminering (dannelse av en dobbeltbinding, en alken eller olefin).
Nomenklatur
Nomenklaturen for disse alkoholene er ikke annerledes enn andres. Det er vanlige eller tradisjonelle navn, og de systematiske navnene styrt av IUPAC.
Hvis hovedkjeden og dens forgreninger består av en anerkjent leiegruppe, brukes den til det tradisjonelle navnet; Når det ikke er mulig å gjøre det, brukes IUPAC -nomenklaturen.
Tenk for eksempel følgende tertiær alkohol:
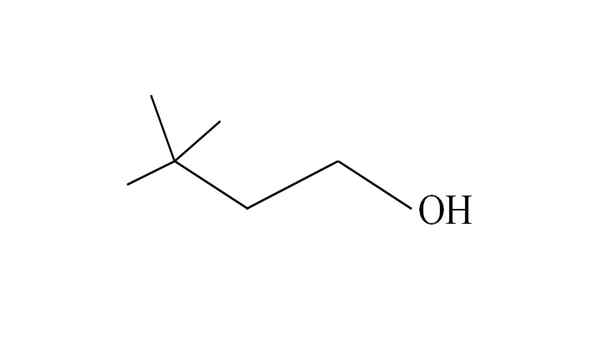 3,3-dimetyl-1-butanol. Kilde: Gabriel Bolívar.
3,3-dimetyl-1-butanol. Kilde: Gabriel Bolívar. Det begynner å oppregne karbonatomer fra høyre til venstre. I C-3 er det to grupper CH3 av substituenter, og derfor er navnet på denne alkoholen 3,3-dimetyl-1-butanol (hovedkjeden har fire karbonatomer).
På samme måte består hele kjeden og dens konsekvenser av neohexilo -gruppen; Derfor kan det tradisjonelle navnet være neohexylalkohol, eller neohexanol.
Eksempler
Til slutt nevnes noen eksempler på tertiære alkoholer:
-2-metyl-2-propanol
-3-metyl-3-heksanol
-Biciclo [3,3,0] oktan-1-ol
-2-metyl-2-butanol: Ch3Ch2COH (kap3)2
Formlene for de tre første alkoholene er representert i det første bildet.
Referanser
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. (5. utgave). Redaksjonell Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Gunawardena Gamini. (31. januar 2016). Tertiær alkohol. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Ashenhurst James. (16. juni 2010). Alkoholer (1) - Nomenklatur og egenskaper. Gjenopprettet fra: MasterorganicChemistry.com
- Clark J. (2015). Vi introduserer alkoholer. Gjenopprettet fra: Chemguide.co.Storbritannia
- Organisk kjemi. (s.F.). Tema 3. Alkoholer. [PDF]. Gjenopprettet fra: sinorg.Uji.er
- Nilanjana Majumdar. (3. mars 2019). Syntese av chiral tertiær alkohol: Betydelig utvikling. Gjenopprettet fra: 2.Kjemi.MSU.Edu
- « Formativ periode med Amerika opprinnelse, egenskaper, produkter
- Hvordan var det europeiske samfunnet i første halvdel av det nittende århundre »

