Alkenes
- 3687
- 766
- Marius Aasen
 Alkener eller olefiner er umettede hydrokarboner som har minst et dobbelt karbon-karbonbinding i strukturen
Alkener eller olefiner er umettede hydrokarboner som har minst et dobbelt karbon-karbonbinding i strukturen Hva er alkener?
De Alkener eller olefiner De er umettede hydrokarboner som har minst en dobbeltbinding i strukturen. De kalles olefiner på grunn av eten eller etylenes evne til å reagere med halogener til å produsere olje eller olje. Foreløpig har begrepet olefinas blitt brukt, og disse forbindelsene kalles nå alkener.
De fysiske egenskapene til alkener påvirkes av deres molekylvekt, så vel som deres kullsyreholdige skjelett. For eksempel er alkener med 2 til 4 karbonatomer (Buteno Etene) gasser. Med 5 til 18 karbonatomer i den lange kjeden er væske. Mens alkener med mer enn 18 karbonatomer er faste.
Tilstedeværelsen av dobbeltbinding gir stor reaktivitet, og opplever dermed mange kjemiske reaksjoner, for eksempel tilsetning, eliminering, hydrogenering, hydrering og polymerisasjon, som lar den generere en rekke bruksområder og applikasjoner.
Alkener produseres industrielt ved termisk sprekker av høy molekylvekt (parafinvoks); Katalytisk dehydrogenering og klorering-dehydrokloklinering.
Kjemisk struktur av alkener
 Kilde: Selvlaget
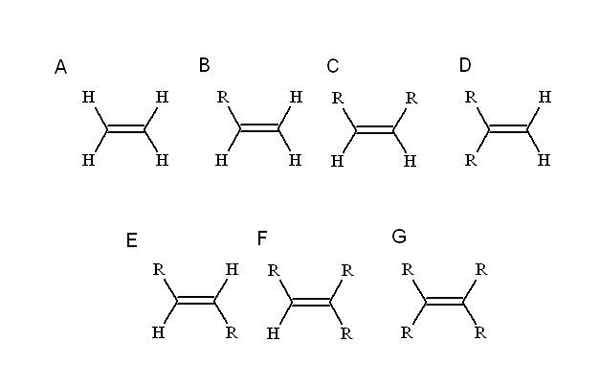
Kilde: Selvlaget Alkener er preget av å ha en eller flere dobbeltkoblinger i strukturen. Dette er representert som C = C, med begge karbonatomer en SP -hybridisering2.
Derfor er kjedeområdet der dobbeltbindingen er, eller umettethet, flat. Det er også meritor å påpeke at de to karbonatområdene kan knyttes til to andre substituenter (eller grupper).
Hvilke substituenter? Alle som erstatter en av de enkleste Alkens hydrogener: etylen (eller eteno). Fra ham (A, overlegen bilde) R, som er en alquilisk substituent, okkuperer stedet for et av de fire hydrogenene for å forårsake en mono-substituert alken (b).
Så langt, uavhengig av hvilket hydrogen som erstattes, endres ikke identiteten til B. Dette betyr at det mangler stereoisomerer, sammensatt med like kjemiske formler, men med en annen romlig disposisjon av atomene.
Kan tjene deg: ekvivalenspunktStereoisomerer
Når et andre hydrogen erstattes av en annen R, som i C, nå stereoisomerer C, D og E. Dette er fordi romlige orienteringer med hensyn til begge r kan variere, og for å skille hverandre, brukes cis-trans eller e-z-oppgaver.
I C, Di-Substitute Alkene, kan de to R være kjeder i hvilken som helst lengde eller noen heteroátomo. Den ene er i frontal stilling i forhold til den andre. Hvis de to R består av samme substituent, F, for eksempel, er C stereoisomer-cis.
I D er begge R -gruppene enda nærmere, siden de er knyttet til det samme karbonatom. Dette er den geminale stereoisomeren, selv om det er mer enn en stereoisomer, det er faktisk en terminal dobbeltbinding, det vil si at det er på slutten eller prinsippet i en kjede (av den grunn har den to hydrogener det andre karbon).
Og i E, den mest stabile av stereoisomerer (eller geometriske isomerer), blir de to R -gruppene separert med en større avstand, som krysser diagonalen til dobbeltbindingen. Hvorfor er den mest stabile? Det er fordi som den romlige separasjonen mellom dem er større, så det er ingen søsterspenning mellom de to.
På den annen side er F og G henholdsvis tri- og tetra-revaced alkener. Igjen, de er ikke i stand til å generere noen stereoisomer.
Fysiske og kjemiske egenskaper til alkener
Løselighet
De er ikke uproduksjon med vann på grunn av deres lave polaritet. Men de oppløses i organiske løsningsmidler.
Fusjonspunkter ved ºC
Etano -169, Propeno -185, 1 -Pentin -165, 1 -hepteno -119, 3 -oktein
-101,9, 3 -ingen -81,4 og 5 -dechenum -66,3.
Kokepunkt i ºC
Etano -104, Propeno -47, Trans2Buteno 0,9, Cis2Buteno 3,7, 1-Penten 30, 1-Hepteno 115, 3-OK 122, 3-Noneno 147 og 5-påtekt.
Kan tjene deg: laboratoriefilter): Kjennetegn, funksjoner, typerKokepunktet øker i direkte forhold til antall alkenkarboner. På den annen side, jo mer forgrenet struktur er, desto svakeste er dens intermolekylære interaksjoner, noe som gjenspeiles i reduksjonen i kokende eller fusjonspunkt.
Tetthet
Etano 0,6128 mg/ml, Propeno 0,6142 mg/ml og 1-buten 0,6356 mg/ml, 1-pente 0,64 mg/ml og 1-heksen 0,673.
I alkener er den maksimale tettheten 0,80 mg/ml. Det vil si at de er mindre tette enn vann.
Polaritet
Det avhenger av den kjemiske strukturen, substitusjonene og tilstedeværelsen av andre funksjonelle grupper. Alkenene har en dipmers, og dermed 2-buten cis isomer.
Alkenes reaktivitet
Alken har stor kapasitet til å reagere på grunn av dobbeltkoblingene de har. Blant reaksjonene som er involvert er: tilsetning, eliminering, erstatning, hydrogenering, hydrering og polymerisasjon.
Tilleggsreaksjon
H2C = Ch2 + Cl2 => Clch2-CCLH2 (Etylen -diklorid)
Hydrogeneringsreaksjon
Det forekommer ved høye temperaturer og i nærvær av tilstrekkelige katalysatorer (PT, PD eller fint delt)
Ch2= Ch2 + H2 => Ch3-Ch3 (Etano)
Hydreringsreaksjon
Reaksjon som er kilden til alkoholgenerering fra oljederivater:
H2C = Ch2 + H2O => h3C-CH2Å (etylalkohol)
Polymerisasjonsreaksjoner
Etylen i nærvær av katalysatorer som aluminiumforsøk og titan tetrakloridpolymeriza i polyetylen, som inneholder omtrent 800 karbonatomer. Denne typen polymer kalles tilleggspolymeren.
Bruk og applikasjoner av alkener
Polymerer
- Polyetylen med lav tetthet brukes til fremstilling av poser, drivhusplast, emballasje, oppvasken, fartøyer osv. Mens den høye tettheten er mer stiv og mekanisk motstandsdyktig, bruker du i fremstilling av bokser, møbler, beskyttere som hjelmer og knær, leker og paller.
- Polypropylen, propylenpolymer, brukes til utdyping av containere, ark, laboratorieutstyr, leker, emballasjefilmer, SOGAS -filamenter, møbeltrekk og tepper.
- Polyvinylklorid (PVC) er en polymer av vinylklorid som brukes i fremstilling av rør, fliser for gulv, kanaler, dører og Windows -rammer, etc.
- Polybutadien, polymer av 1,3-butadien, er beregnet på fremstilling av lagerbånd, slanger og kjøretøybelter, samt for belegg av metallbokser.
- Etylen- og propylen -kopolymerer brukes til fremstilling av slanger, kropp og deler av chassiset for tekstiler, etc.
Alkenes
- De brukes til å oppnå løsningsmidler som etylenglykol og dioksan. Etylenglykol brukes som frostvæske i bilradiatorer.
- Etylen er et hormon av planter som kontrollerer vekst, spiring av frø og utvikling av frukt. Derfor brukes det til å indusere modning av bananer når de når målet.
- De brukes som råstoff for fremstilling av mange forbindelser som alkylhalogenider, etylenoksid og spesielt etanol. De har også bruk i industri, personlig pleie og medisin.
- De brukes til å skaffe og produsere lakk, vaskemidler, aldehyder og drivstoff. 1,3-Butadieno brukes som råstoff i fremstilling av syntetiske gummier.
Referanser
- Kjemioppdrag. Fysiske egenskaper til alkener. Tatt fra: Kjemi-tilordning.com
- Wikipedia. (2018). Alken. Hentet fra: i.Wikipedia.org
- Kjemi librettexts. Fysiske egenskaper til alkener. Hentet fra: Chem.Librettexts.org
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). Cengage Learning.
- Francis a. Tortoiseshell. Organisk kjemi. (Sjette utgave., Side 194). Mc Graw Hill.
- Houchton Mifflin Harcourt. (2016). Alkener: Molekylære og strukturelle formler. Hentet fra: Cliffsnotes.com
- Chipera, Angie. (25. april 2017). Hva er en olefin i kjemi? Scienting. Tatt fra: Scienting.com

