Leie konsept, mer vanlige radikaler, struktur
- 3057
- 599
- Jonathan Moe
EN jeg leier Det er en gruppe eller erstatning som stammer fra en alkan ved å eliminere et av dens hydrogener. Det er derfor sammensatt av karbon og hydrogen, og dens generelle formel er CnH2n+1, i stedet for cnH2n+2 For alle ikke -sykliske alkaner, det vil si lineære eller forgrenede kjeder.
Leie, som en gruppe, symboliseres med bokstaven r. Dermed kan molekylstrukturen til mange organiske forbindelser generaliseres med introduksjonen av r. I dem er R bare en del av molekylet, knyttet til skjelettet eller en reaktiv funksjonell gruppe.
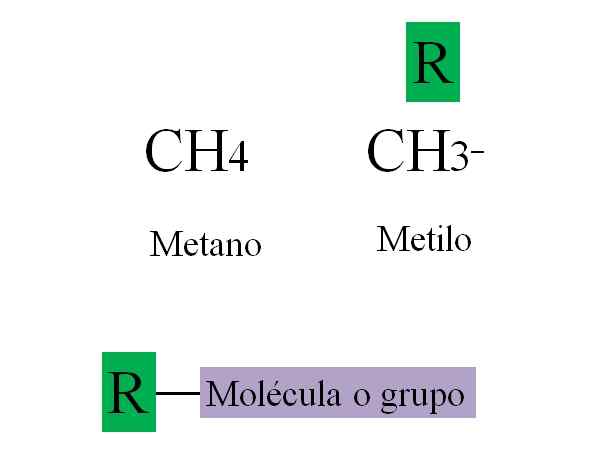 Leiegruppe. Kilde: Gabriel Bolívar.
Leiegruppe. Kilde: Gabriel Bolívar. Det overlegne bildet eksemplifiserer ovennevnte. Metano, kap4, Det er en alkan, og når den mister et av hydrogenene, kobler det til et molekyl eller gruppe, forvandles det til metyl, ch3-. Metylen er ikke en forbindelse: den eksisterer ikke som et fritt molekyl; Med mindre det er metylradikalen, Cho3·, Som er svært reaktiv.
Leie, symbolisert med R, danner et kovalent bånd med resten av et molekyl. Dermed er alquiliske forbindelser representert som RG, der G er en gruppe som omfatter hele molekylet. For eksempel har alkoholer ROH -formel, så de er alkylforbindelser.
[TOC]
Nomenklatur
Nomenklaturen til leien har ingenting å gjøre med inntekten til en eiendom. Dette kommer fra den samme nomenklaturen til alkanen som den stammer fra. På bildet over blir for eksempel metan transformert til metylgruppen. Dermed er det nok å erstatte avslutningen -år, av navnet på alkanen, ved oppsigelse -ilo.
Et annet eksempel har fra etan, Cho3Ch3. Når du mister et av hydrogenet og koblet til et molekyl eller gruppe, blir det forvandlet til etylgruppen, CH3Ch2-.
Kan tjene deg: CO2 Link TypePå samme måte som det oppstår med alle andre alkaner, selv de som består av sykliske kjeder som cyclohexan, som blir transformert til cykloheksyl.
Radikaler mer vanlig
Alkynd radikaler er de "løse og reaktive stykker" som oppnås når R skilles fra et molekyl. Deres overflod er proporsjonale med de leide gruppene de stammer fra. For eksempel Metilo Group, Cho3- Og den radikale metylen, Cho3· De er relativt de samme som vanlige.
Generelt er radikaler eller leiegrupper som kommer fra alkaner som inneholder mindre enn fem karbonatomer i skjelettet, de vanligste. Det vil si over Pentano og alle dens isomerer, blir disse radikaler vanskeligere å finne.
Fordi? Det er to grunner. Den første er at hydrokarboner molekyler, under høye energiforhold, har en tendens til å lide bindingsbrudd, så deres molekylære størrelser og masser reduseres.
Og det andre er at det i naturen er "isomersupper", som er veldig vanskelig å rense ved destillasjon på grunn av den lille forskjellen mellom kokepunktene deres.
Det er slik at de mest tallrike alkystene og deres radikaler er de i kortkjede, med en rekke karbonatomer mindre enn seks. Eksempler på disse ALK -ene er: CH3-, Ch3Ch2-, Ch3Ch2Ch2-, Ch3Ch2Ch2Ch2-, og dets mulige isomerer.
Struktur
Til nå har adressert Alks hatt lineære kjedestrukturer. Strukturene, som forventet, er de samme som for alkanene til de som fortsetter.
Lineære lefes vil resultere i lineære alkimale grupper. Forgrenede topper, derimot, vil generere forgrenede alkaler. Det samme skjer med sykliske alkaner.
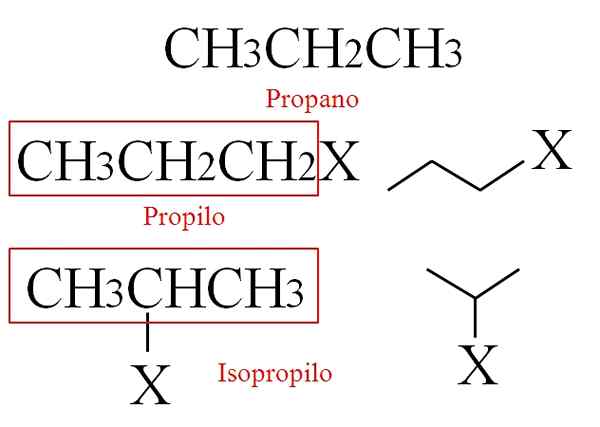
Kan tjene deg: iodometri: fundamenter, reaksjoner, generell prosedyre, brukImidlertid kan lineære alkaner også forårsake tilsynelatende forgrenede alkaler, avhengig av hvilket av karbonatomene som mister hydrogen. Tenk på eksemplet på propan:
 Propankonstruksjon og dens avledede alkalegrupper. Kilde: Gabriel Bolívar.
Propankonstruksjon og dens avledede alkalegrupper. Kilde: Gabriel Bolívar. Hvis du mister et hydrogen fra noen av dets primære karbonatomer, det vil si fra dens ender, oppnås propylgruppen, CH3Ch2Ch2-.
I mellomtiden, hvis hydrogen mister det fra sekundæret eller sentralt karbon, oppnås isopropylgruppen, (CH3)2Ch-. På bildet vises to RX -forbindelser, med R som propyl eller isopropil.
Egenskaper
Leiegruppene reagerer vanligvis ikke fordi C-C- eller C-H-koblingene deres ikke er enkle å bryte. Uansett molekylstruktur, deler de alle en felles eiendom: hydrofobisitet. Det vil si at de ikke viser affinitet for vann eller noen polart løsningsmiddel. Men de gjør for fettet.
Når Renta R -gruppen er veldig stor, eller når det er mange av dem i et molekyl, øker hydrofobisiteten. Dette er det samme for å si at lipofilisiteten øker (kjærlighet til fett). Så jo mer "leid" et molekyl er, jo mer affinitet vil det ha for fett, og vanskeligere vil det være å fjerne det med vann.
Eksempler på alkylforbindelser
Begrepet 'alkylforbindelser' er ekstremt tvetydig når det gjelder organisk kjemi. Gruppen eller molekylet som Rento R -gruppen alltid blir prioritert, blir alltid prioritert. Og det er disse gruppene eller molekylene som definerer familiene til organiske forbindelser.
Men når disse gruppene er mer vanlig i uorganisk kjemi, som med halogener og sulfater, blir det gitt en viss betydning til alquylkomponenten. Noen eksempler vil bli nevnt for å avklare dette poenget.
Kan tjene deg: hydrogen: historie, struktur, egenskaper og brukLeie hacks
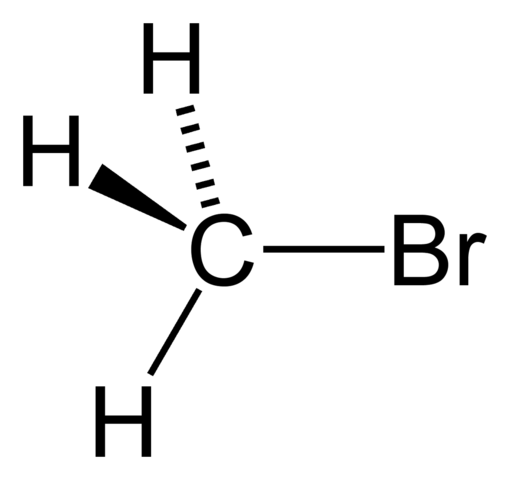 Metylbromid
Metylbromid Leie haluros har en generell Rx -formel, der x er et halogenatom (F, CL, BR og I), og R enhver gruppe eller alkylstatning. For eksempel Cho3BR er metylbromid.
Leie sulfater
 Dimetilsulfat
Dimetilsulfat Rentesulfater har en Roso General Formula3R ', der r og r' er to alkalgrupper som kan være de samme eller forskjellige. Dermed har vi dimetylsulfat, Cho3BJØRN3Ch3 eller meg2SW4.
Leie borater
Leie Borats har en generell formel (RO3) B. For eksempel (Cho3Ch2ENTEN)3B O (Eto)3B kalles etylborat.
Triaquilboros
Tilsvarende har vi Triaquilboros, hvis generelle formel er r3B. For eksempel (Cho3)3B o meg3B kalles Triethylborano (TMB).
Alkoholer
Alkoholene er også alquiliske forbindelser, og deres generelle formel er ROH. Imidlertid mister den eneste tilstedeværelsen av OH -gruppen viktigheten av de leide gruppene. Alkoholer kalles ikke 'alkylhydroksider', fordi leien som sådan ikke er de mest grunnleggende delene av molekylene deres, men OH.
På den annen side er det i de tidligere eksemplene vekt på tilstedeværelsen av de leide gruppene R; Fordi, i regi, halogener, sulfater, boros og boratos er veldig.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Alkyl. Hentet fra: i.Wikipedia.org
- Danielle Reid. (2020). Alkylgruppe: Definisjon og oversikt. Studere. Gjenopprettet fra: Studie.com
- Kjemi librettexts. (6. april 2020). Alkylgrupper. Gjenopprettet fra: Chem.Librettexts.org
- « Sosiale sameksistensstandarder, former, betydning, eksempler
- Kjennetegn voltmeter, drift, hva er det for, typer »

