Amidas
- 4812
- 1
- Jonathan Moe
Vi forklarer hva Amids, deres egenskaper, struktur, typer, nomenklatur og vi gir flere eksempler er
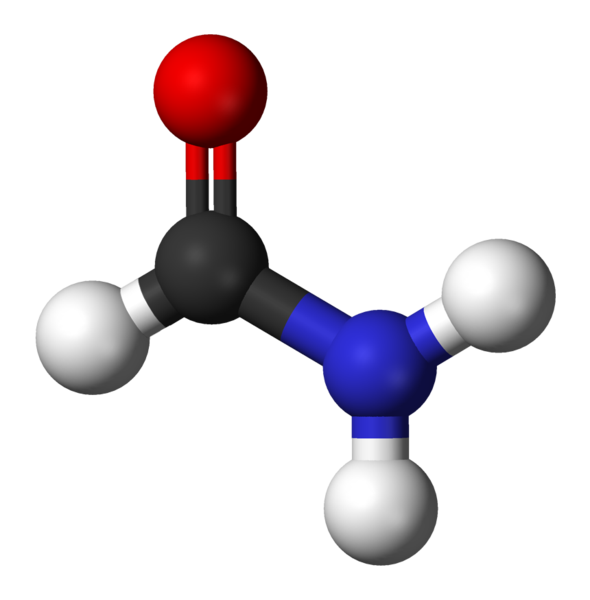
 Formamid, den enkleste amida
Formamid, den enkleste amida Hva er Amidas?
Amidas er en type organiske forbindelser som dannes av foreningen mellom en karboksylsyre og et amin. De kalles også sure aminer og derfra er det nettopp der ordet kommer fra Amid.
Disse forbindelsene er veldig viktige for livet, siden de er en essensiell del av proteiner, peptider og noen hormoner. De er også en del av de nitrogene basene til DNA og RNA, som inneholder vår genetiske informasjon.
Amidas er også veldig viktig i bransjen. For eksempel, Nylonen Det er en av de mest brukte syntetiske fibrene over hele verden og er dannet av en lang kjede med United Amides etter hverandre.
Amider brukes også mye i legemiddelindustrien, siden de er en del av medisiner som lidokain.
Kjennetegn på amider
- Nesten alle er solide: Alle amider er solide ved romtemperatur, bortsett fra den minste og enkleste som er formamid. Sistnevnte er flytende.
- De har et høyt kokepunkt: Sammenlignet med karboksylsyrer og aminer som de er laget, har amider et høyt kokepunkt. For eksempel acetamid (velg3Conh2) Det dannes av forening av eddiksyre (eddik) med ammoniakk. Kokepunktet for acetamid er 221,2 ºC, mens eddiksyre er 118 ºC og ammoniakk er -33,34 ºC.
- Noen er vannløselige: Den minste amidas blandes godt med vannet, så det er lett å løse dem opp i det. Når de blir større, blir de imidlertid mindre løselige.
- De er mindre grunnleggende enn aminer: En amida er alltid mindre grunnleggende (eller surere) enn aminet det kommer. Faktisk kommer navnet Amida fra å kombinere megNa+acigir.
- Lenken din er lett ødelagt: Hvis en sterk base som katalysator blir tilsatt, reagerer amidene raskt med vann. Denne reaksjonen kalles hydrolyse, og under den samme er Amida ødelagt for å danne den opprinnelige syre og amin.
- De er fargeløse og toaletter: Generelt er amider stoffer som ikke har en farge eller karakteristisk lukt.
Funksjonell gruppestruktur
Kjemisk er AMIDA en funksjonell gruppe som inneholder en karbonylgruppe (C = O) fra en karboksylsyre, koblet til nitrogen fra ammoniakk eller amin. Amides generelle struktur er:
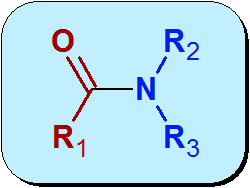 Den røde delen av molekylet i det forrige bildet kommer fra karboksylsyre og kalles Acyl. Den blå delen kommer fra Amida.
Den røde delen av molekylet i det forrige bildet kommer fra karboksylsyre og kalles Acyl. Den blå delen kommer fra Amida.
Et kjennetegn ved strukturen til Amids som skiller dem fra aminene, er at paret med frie elektroner som nitrogen eier det med karbonylgruppen gjennom en prosess som kalles resonans. Dette er det som gjør Amids mindre grunnleggende enn aminene.
Typer amider
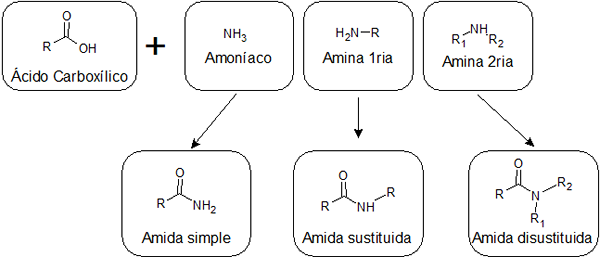
Avhengig av om syren er kombinert med ammoniakk, med en primær amina eller med en sekundær amin, kan tre typer amider med forskjellige strukturer oppnås:
Enkle amider
De er dannet av unionen mellom en karboksylsyre og ammoniakk. Denne typen amida har en gruppe -nh2 Knyttet til karbonylgruppen. Enkle amider kan danne flere hydrogenbindinger til hverandre og med vann, så de er vanligvis mer løselige enn de som er erstattet.
- Enkle amida eksempler: formamid, acetamid og butyramid.
Erstattet amider
De oppnås ved forening av en syre og en primær amin. I dette tilfellet en av hydrogenene til -nh2 Av de enkle amidene erstattes av en alkyl, og det er derfor de blir fortalt erstattet.
- Eksempel på en erstattet amid: Koblingen mellom aminosyrer i proteiner.
Vantro amider
De kommer fra reaksjonen mellom en syre og en sekundær amin. I dette tilfellet er begge hydrogener av gruppen -NH2 De erstattes av alkylgrupper. Følgende amider har ikke hydrogen festet til nitrogener, slik at de ikke kan danne hydrogenbroer med hverandre, og bare en svakt med vann. Dette gjør dem mindre oppløselige i vann enn de andre amidene.
Laktamas, primær, sekundær og tertiær amidas
Bortsett fra de tre typene nylig nevnte amider, er det også Primære, sekundære og tertiære amider, Det er forskjellig ved å ha en, to eller tre sure grupper forenet til nitrogenatom.
Endelig danner noen amider lukkede sykluser. I dette tilfellet kalles forbindelsen Lactam. Laktamas er veldig viktige i naturen. For eksempel er uracil som er en del av RNA, en laktam.
Nomenklatur av Amidas
Enkle amider
Enkle amider er navngitt fra navnet på karbonkjeden til syren som de kommer fra (hovedkjeden). Navnet er bygget ved å plassere prefikset som indikerer antall karbonatomer (metan-, butan-, heksan-, etc.) eller det vanlige navnet på syren ved å fjerne terminering -OICO eller -ICO (som i AcétICO) Og legge til avslutning -amida.
- Eksempel: Amid som kommer fra eddiksyre, kalles acetamid og den som kommer fra propanóic -syen kalles propanamid.
Erstattet og uaguøse amider
I dette tilfellet begynner det med å utnevne alkylgruppene som er forent til nitrogen, forut for brev n-. Da blir resten av Amida navngitt som hovedkjeden.
Det kan tjene deg: Svovel: Historie, egenskaper, struktur, innhenting, brukEksempel:
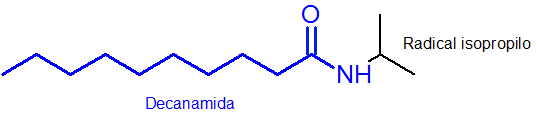 Som det fremgår av, er substituenten som er festet til nitrogen en isopropylgruppe, så den er inkludert i navnet som n-osopropyl (den siste "o" blir alltid fjernet til navnet på radikalen).
Som det fremgår av, er substituenten som er festet til nitrogen en isopropylgruppe, så den er inkludert i navnet som n-osopropyl (den siste "o" blir alltid fjernet til navnet på radikalen).
Resten av hovedkjeden, som har AMIDA funksjonelle gruppe, har 10 karbonatomer. Det vil si at navnet ditt må ha prefikset dekan- etterfulgt av Amida-avslutningen, eller, dekanamid. Så han Fullt navn er n-osopropildecanamide.
Eksempler på amider
- Benzamid c6H5Conh2
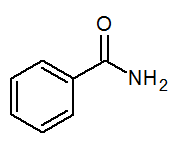
- N, N-dimetylacetamid CH3Med (kap3)2
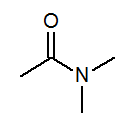
- Acetamid Ch3Conh2
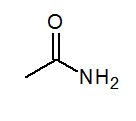
- Fenylacetamid (ca6H5) Ch2Conh2
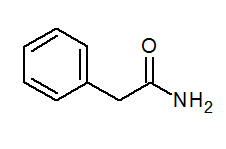
- N-Butil-N-Propilformamide HCON (C3H7) (C4H9)
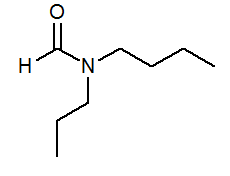
- 4-hydroksybanamid Ch2(Å) Cho2Ch2Conh2
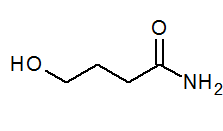
- Urea co (nh2)2
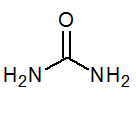
- Propanamid Ch3Ch2Conh3
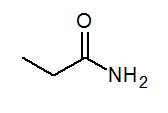
- N-Butil-2-Echopilpetanamida Ch3Ch2Ch2CH (c3H7) Conh (C4H9)

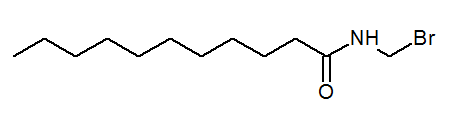
- N- (bromometyl) undecanamide cho3(Ch2)9Conhch2Br
Referanser
- Britannica, t. Redaktører av Encyclopaedia (2019, 15. mai). Amid. Britannica Encyclopedia. Hentet fra Britannica.com
- Amisstrukturer og navn. (2020, 17. august). Hentet fra Chem.Librettexts.org
- Carey, f. TIL. (2008). Organisk kjemi. Boston: McGraw-Hill Higher Education.
- Smith, m., Mars, j., & Mars, j. (2001). Marchs avanserte organisk kjemi: reaksjoner, mekanismer og struptur. New York: Wiley.
- Zabicky, J. (1970). Kjemien til AMIS, del 1. New York: Wiley

