Anafilotoksiner typer, funksjoner og mottakere
- 810
- 124
- Oliver Christiansen
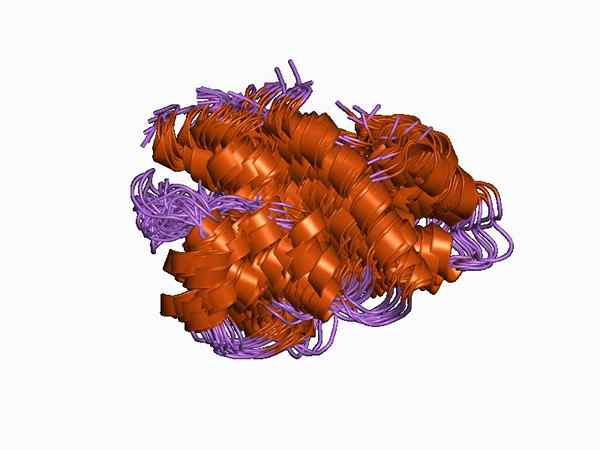
De Anafilotoksiner De er peptidfragmenter med lav molekylvekt som genereres ved aktivering av komplementsystemet. De er svært hydrofile, med en struktur i Alpha Hall koblet av 3 disulfidbroer.
De aktiveres proteolytisk ved brudd på et bestemt sted, og danner fragmenter A og B. Disse peptidene binder seg til spesifikke reseptorer uttrykt på overflaten av cellene og forsterker en rekke inflammatoriske reaksjoner, og fungerer som cellulære aktivatorer.
 C5A anafylotoksin -protein. Av Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain (https: // CreativeCommons.org/lisenser)], fra Wikimedia Commons.
C5A anafylotoksin -protein. Av Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain (https: // CreativeCommons.org/lisenser)], fra Wikimedia Commons. Effektorfunksjonene inkluderer kjemotoksis, frigjøring av inflammatoriske mediatorer og granulocytt, mastceller og makrofager. Nylig har det også blitt vist at anafylotoksiner genereres lokalt i vevene ved tilstedeværelse av patogener.
[TOC]
Folkens
Anafilotoksiner inkluderer C3A, C5A og C4A peptider. Dette er fragmenter av lav molekylær massedeling (∼10 kDa) av α -kjeden til komponentene i henholdsvis komplementet C3, C4 og C5 som frigjøres under komplementaktivering.
Imidlertid skal det bemerkes at for C4A er det bare vist at den blir sammen med mottakeren med lav affinitet og ingen spesifikk mottaker av det samme er identifisert.
For sin del er C5a den kraftigste av disse peptidene, det vil si at det fremmer betennelse og er en attraktiv sjimio for nøytrofiler, makrofager og monocytter.
Selv om lavere virveldyr har komplementsystemer som antas å fungere på en lignende måte som pattedyr, har anafyloksinreseptorer ikke tidligere blitt karakterisert i noen ikke -mammal virveldyr.
Funksjoner
Anafilotoksiner genereres fra den enzymatiske splittelsen under komplementaktiveringskurset gjennom klassiske, lektin eller alternative veier.
Det kan tjene deg: Flora og Fauna fra ItaliaI komplementaktiveringsfosset fører delingen av C3 eller C5 for den konverterte C3 eller C5 til generering av et stort fragment, C3B eller C5B og et lite fragment av peptid, C3A eller C5A.
C3B og C5b fortsetter komplementaktiveringsfossen på mikrobielle eller cellulære overflater, mens C3A og C5A frigjøres i væskefasen for å fungere som anafilotoksiner, som formidler forskjellige biologiske handlinger.
De øker vaskulær permeabilitet, stimulerer sammentrekninger av glatt muskel og induserer frigjøring av histamin fra mastceller og sekretoriske granulater av granulocytter og makrofager.
I tillegg er C5a, en av de kraftigste peptidene, en kraftig kjemoatraente for nøytrofiler og andre leukocytter.
Ingen kjemiatrayente egenskaper er ikke blitt tilskrevet C4A, mens de av C3A hovedsakelig ser ut til eosinofiler, mastceller og hemopoietiske stamceller.
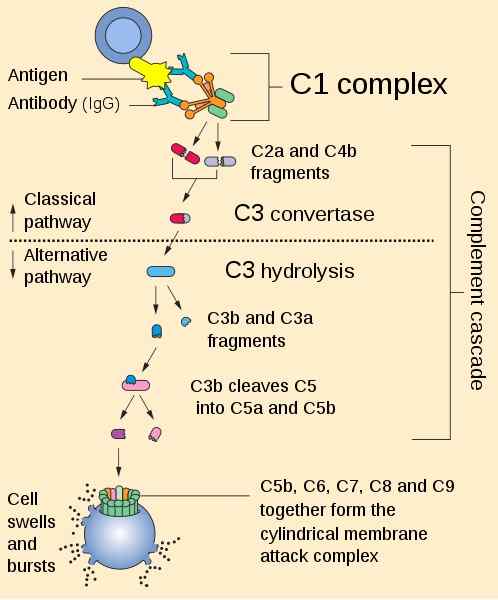
Sammendrag av den komplementiske fossehavsaktiveringsveien. Av Perhelion [Public Domain (https: // creativeCommons.org/lisenser)], fra Wikimedia Commons.
.
Association of C5a og C3a med patogenese
Selv om C5A og C3A -betennelse spiller en viktig rolle i kontrollen av infeksjonen, har en serie kliniske studier vist at de også er assosiert med patogenesen av flere inflammatoriske og autoimmune sykdommer som sepsis, den systemiske lupus erythematosus (LES), tapet av graviditet, antifosfolipidantistoffsyndrom (SAFL), iskemi og astma.
På denne måten har det blitt antydet at å angripe reseptorene og/eller ligandene til C5A og C3A kan redusere uønskede inflammatoriske responser, samt vevsskade på visse patologiske forhold. C5A og C3A kan være terapeutisk hvit effektiv.
Kan tjene deg: ABO -system: inkompatibilitet, arv og bevisReseptorer
Generelt utøver anafilotoksiner de fleste biologiske aktiviteter gjennom forening av tre relaterte reseptorer, det vil si; C3A -mottakeren, C5A -mottakeren og C5A -typen mottaker, C5L2.
Hos mennesker er tre typer transmembranreseptorer identifisert som medierer virkningene av anafylotoksiner: C3AR, som spesifikt blir med C3A; C5AR, som binder seg til C5a; og C5L2, som de tre anafilotoksinene kan være ligander.
De to første reseptorene er koblet til regulatoriske G -proteiner, mens C5L2 -mottakeren er vist.
Fordelingen av disse reseptorene er ikke begrenset til leukocytter. De kommer også til uttrykk i mange typer ikke -myloidceller, inkludert hepatocytter, lungeepitelceller, endotelceller, hjerneastrocytter og mikrogliale celler.
I denne typen celler kan de formidle deltakelse av anafilotoksiner i flere vaskulære, lunge, regenerative og degenerative nevrologiske tilstander.
Hvis anafylotoksiner ikke binder seg til reseptorene sine, blir disse raskt fordøyd av plasmakarboksyper, som eliminerer den C-terminale argininresten av hvert peptid.
Argininderivater er inaktive eller har aktiviteter 10 til 1000 ganger lavere enn for naturlige peptider.
Komplementsystemer i lavere virveldyr
De nedre virveldyrene, som krypdyr, amfibier og fisk, har komplementsystemer som på mange måter anses som funksjonelt som pattedyr.
Beskyttende immunresponser er påvist ved komplement, for eksempel cytolyse og opsonisering, hos noen av disse dyrene.
Kan tjene deg: Hva er leptoten?Nylig har det blitt vist at Tunicado C3A Ciona intestinalis Den har kjemotaktiske aktiviteter for avstemte hemocytter, noe som antyder tilstedeværelsen av en C3AR -reseptor hos disse dyrene.
Disse protokordningene har kanskje ikke C4A og C5A, så det antas at den klassiske komplementaktiveringsveien, som produserer C4A og den litiske ruten, som genererer C5A er fraværende i disse dyrene.
Imidlertid har gnathostomes alle kjente komplementaktiveringsveier, og C3, C4 og C5 molekyler av flere fiskeslag er blitt identifisert. Interessant nok har fisk flere isoformer av flere av komplementkomponentene, inkludert C3, C2 / BF, C4 og C5.
Selv om forskjellige funksjoner er foreslått for C3 -isoformer, gjenstår det å etablere om det er forskjellige reseptorer for disse isoformene.
Referanser
- Av Yang. Anapofylatoxens. Håndbok for biologiske aktive peptider.pp.625-630 http: // dx.gjør jeg.org/10.1016/B978-0-12-385095-9.00085-3
- Gennaro R, Simonic T, Negri A, Mottola C, Secchi C, Ronchi S, Romeo D. C5A -fragment av bovint komplement. Rensing, bioanalyser, aminino-syre-sekvens og andre strukturelle studier. European Journal of Biochemistry. 1986; 155 (1): 77-86.
- Holland CH, Lambris JD. Funksjonell C5a anafylatoksinmottaker i en teleost art. Journal of Immunology. 2004; 172 (1): 349-355.
- Klos A, Tenner AJ, Johswich K, Ager R, Reis ES, Köhlc J. Anapofylatoksjonens rolle i helse og sykdom. Molekylær immunologi. 2009; 46 (14): 2753-2766.
- Ogata RT, Rosa PA, ZEPF NE. Sekvens av genet for murint komplementkomponent C4. Journal of Biological Chemistry. 1989, 264 (28): 16565-16572.
- Peng Q, Li K, Sacks SH, Zhou W. Rollen til anafylatoksoner C3A og C5A i å regulere medfødt og adaptiv immunrespons. Betennelse og allergimålemål. 2009; 8 (3): 236-246.
- « Sidekommunikasjonsegenskaper, fordeler, ulemper, eksempler
- Turdiagram Hva er det for, hvordan gjøres det, eksempler »

