Antimonhistorie, struktur, egenskaper, bruksområder og risikoer

- 731
- 26
- Marius Aasen
Han antimon Det er en skinnende, sølvmetalloid, og med en viss blå fargetone. Det faste stoffet er også preget av å være veldig sprø og av plateepitel. Det tilhører gruppe 15 av det periodiske bordet, ledet av nitrogen. Etter vismut (og Moscowium) er det det tyngste elementet i gruppen.
Det er representert av det kjemiske symbolet SB. I naturen er det hovedsakelig funnet i stabler og Ullmannite mineraler, hvis kjemiske formler er SB2S3 og NISBS, henholdsvis. Den høye tendensen til å danne sulfider i stedet for oksider er fordi det er kjemisk mykt.
 Krystallinsk antimon. Kilde: Beste sci-fatcs [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Krystallinsk antimon. Kilde: Beste sci-fatcs [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] På den annen side er antimonet også fysisk mykt, og presenterer en hardhet på 3 på Mohs -skalaen. Den er stabil ved romtemperatur og reagerer ikke med luftoksygen. Men når han er oppvarmet i nærvær av oksygen, danner han antimon -trioksid, SB2ENTEN3.
Det er også motstandsdyktig mot virkningen av svake syrer; Men varmt blir angrepet av nitrogen og saltsyrer.
Antimonen har mange bruksområder, blant dem brukes i legeringer med bly og tinn, i fremstilling av batterier for kjøretøy, lav friksjonsmaterialer, etc.
Denne metalloiden har det sjeldne eide for å øke volumet når de størkes, slik at legeringene kan okkupere plassen som brukes til å forme instrumentet som er ønsket å produsere fullstendig.
[TOC]
Historien om oppdagelsen din
BC
Det er bevis på at fra 3100 til.C, antimon sulfid ble brukt som kosmetikk i Egypt. I Mesopotamia ble det funnet nåværende Irak, rester av en vase og en annen gjenstand som angivelig er dato mellom 3000 og 2200 år til.C, der det ble brukt i sin antimonium.
Introduksjon av begrepet
Roman Erúdito Plinio El Viejo (23-79 D.c) beskrev bruken av antimon, som han kalte Estibio, i utdypingen av syv medisiner i hans naturhistoriske traktat. Alchemist Abu Mussa Jahir ibn Hayyan (721-815) tilskrives innføringen av begrepet antimon for å utnevne elementet.
Han brukte følgende etymologi: 'anti' som et synonym for fornektelse, og 'mono' for bare. Da ønsket han å understreke at antimonet ikke var alene i naturen. Det er allerede kjent at det er en del av svovelmineraler, som som andre elementer.
Å skaffe
Gresk naturist pedanius diascorides antas å oppnå rent antimon, ved å varme opp antimon sulfid i en luftstrøm. Den italienske metallurgiske Vannocio Biringucio, i Pyrotechnics Book (1540), gjør en beskrivelse av en metode for å isolere antimoniet.
Den tyske kjemikeren Andreas Libavius (1615), ved bruk av en støpt blanding av jern, oppnådde antimon sulfid, salt og kaliumtartrato, produksjonen av et krystallinsk antimon.
Den første detaljerte rapporten om antimonet ble laget i 1707 av den franske kjemikeren Nicolas Lemery (1645-1715), i sin bok behandlet på antimoniet.
Kan tjene deg: kobberklorid (i) (CUCL): struktur, egenskaper, brukAntimonstruktur
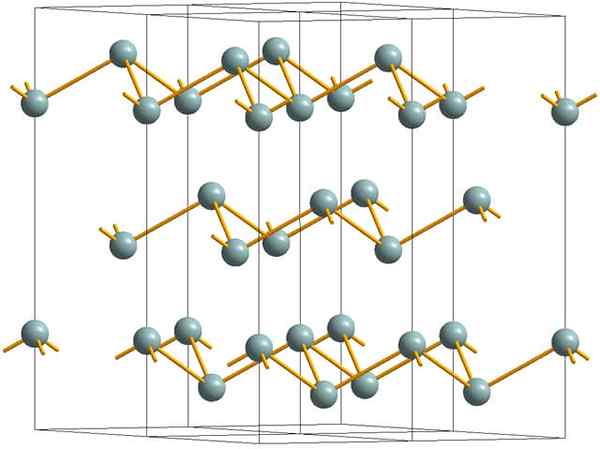 Rynkete lag som utgjør den krystallinske strukturen til metallisk eller sølvantimon. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Rynkete lag som utgjør den krystallinske strukturen til metallisk eller sølvantimon. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Det øvre bildet viser strukturen til rynkete lag som er adoptert av arsenatomer. Imidlertid vedtar gråaktig antimon, bedre kjent som metallisk antimon, også denne strukturen. Det sies at det er "rynket" fordi det er SB -atomer som stiger og faller fra planet som er sammensatt av laget.
Disse lagene, selv om de er ansvarlige for fotonene som samhandler med det for å skinne sølvglitter, noe som gjør antimonen som et metall, er sannheten at kreftene som forener dem er svake; Herfra til de tilsynelatende metallfragmentene av SB kan enkelt vises og er sprø eller joggesko.
I tillegg er ikke SB -atomer i rynkete lag nok til å gruppere atombanene sine og dermed lage et bånd som tillater elektrisk ledning.
Ser du en gråaktig sfære individuelt, kan du se at den har tre SB-SB-lenker. Fra et høyere plan kunne SB sees i midten av en trekant, med tre SB lokalisert i toppunktene. Trekanten er imidlertid ikke flat og har to nivåer eller gulv.
Den laterale reproduksjonen av slike trekanter og deres koblinger etablerer rynkete lag, som er justert for å danne romboébiske krystaller.
Allotropy
Den nybeskrevne strukturen tilsvarer det gråaktig antimon, den mest stabile av de fire alotropene. De tre andre alotropene (svart, gult og eksplosivt) er metastabile; det vil si at de kan eksistere under veldig strenge forhold.
Det er ikke for mye informasjon om strukturer. Det er imidlertid kjent at det svarte antimonet er amorf, slik at strukturen er rotete og intrikat.
Det gule antimoniet er stabil under -90 ºC, det oppfører seg som et ikke -metallisk element, og kan antas å være med å bestemme av små SB -agglomerater4 (ligner på fosfor); Når den blir oppvarmet forvandles den til den svarte alotropen.
Og med hensyn til det eksplosive antimonet, består det av en gelatinøs tank dannet på katoden under elektrolysen av en vandig løsning av et antimonhalogenid.
Til den minste sterke søppel.
Egenskaper
Atomvekt
121,76 g/mol.
Atomnummer
51.
Elektronisk konfigurasjon
[Kr] 4d105s25 s3.
Oksidasjonsstater
-3, -2, -1, +1, +2, +3, +4, +5.
Fysisk beskrivelse
Skinnende sølv, sprø, plateepitel, med en blå fargetone. Det kan også vises som et svart støv.
Smeltepunkt
630,63 ºC.
Kokepunkt
1.635 ºC.
Tetthet
-6.697 g/cm3 i romtemperatur.
-6,53 g/cm3 I flytende tilstand, temperatur lik eller større til smeltepunktet.
Fusjonsvarme
19,79 kJ/mol.
Fordampningsvarme
193,43 kJ/mol.
Kan tjene deg: Kobbersulfid: Struktur, egenskaper, bruksområderMolar kalorikapasitet
25,23 J/mol.K
Elektronegativitet
2.05 (Pauling Scale).
Atomisk radio
140 pm.
Hardhet
Det er et mykt element, med en hardhet på 3 på MOHS -skalaen og kan riper av glass.
Stabilitet
Det er stabilt ved romtemperatur, og opplever ikke oksidasjon. Det er også motstandsdyktig mot syreangrep.
Isotoper
Den har to stabile isotoper: 121SB og 123SB. I tillegg er det 35 radioaktive isotoper. Den radioaktive isotopen 125SB er den med størst halvliv: 2,75 år. Generelt avgir radioaktive isotoper β -stråling+ og β-.
Elektrisk og termisk ledningsevne
Antimon er en dårlig leder av varme og strøm.
Kjemisk reaktivitet
Kan ikke fortrenge hydrogenet fra fortynnede syrer. Ionisk kompleks form med organiske og uorganiske syrer. Det metalliske antimonet reagerer ikke med luften, men det blir raskt omdannet til oksid til den våte luften.
Halogener og sulfider oksiderer lett antimon, hvis prosessen skjer ved høye temperaturer.
applikasjoner
Legeringer
Antimonen brukes i legering med bly for utdyping av plater for bilbatterier, noe som forbedrer motstanden til platene, så vel som lastens egenskaper.
Bly- og tinnlegering har blitt brukt for å forbedre egenskapene til sveisene, så vel som for sporingsbulene og kassettene. Det brukes også i legeringer for elektrisk kabelbelegg.
Antimonen brukes i antifriction -legeringer, i tilberedning av peeling og herdingslegeringer med lavt tinninnhold i fremstilling av organer og andre musikkinstrumenter.
Den presenterer den karakteristiske, som deles med vannet, med økende volum når det kondenserte; Så antimonen som er til stede i legeringer med bly og tinn, fyller alle rommene i formene, og forbedrer definisjonen av strukturene som er laget med disse legeringene.
Brannhemmende
Antimontrioksid brukes til utdyping av Igniphed -forbindelser, alltid i kombinasjon med halogenerte brannhemmere, bromuros og klorid.
Brannhemmere kan reagere med oksygen og radikale atomer Å, som hemmer brann. Disse Ignifed brukes i klær til barn, leker, fly og i bilstoler.
De er også lagt til i polyesterharpikser, og i glassfiberkomposser for brukte gjenstander som lette flymotorer dekker.
Antimonforbindelser som brukes som brannhemmere inkluderer: antimon oksyklorid, sbocl; antimon pentoksid, sbo5; Antimon Trichloride, SBCL3; og antimon trioksid, SBO3.
Elektronikkfelt
Det brukes i fremstilling av halvledere, dioder, midtre infrarøde detektorer og i utdyping av transitorer. Antimon med høy renhet, brukt i halvledeteknologi, oppnås ved reduksjon av antimonforbindelser med hydrogen.
Kan tjene deg: faktorer som påvirker løselighetenMedisin og veterinær
Antimonforbindelser har blitt brukt i medisin siden eldgamle tider som eméticas og antiprotozoa. Kaliumkaliumtartrato (estetisk tartar) ble brukt som antisquisosomal i lang tid; også brukt som en slimløselig, diaphoretisk og emético.
Antimonalter har også blitt brukt i kondisjonering av huden til drøvtyggere; slik som aniomalin, og litium og antimon Tiomalate.
Meglumin antimon er et medikament som brukes i behandlingen av leishmaniasis i ytre søkelys hos husdyr. Skjønt, de terapeutiske fordelene var knappe.
Pigmenter og malerier
Antimonforbindelser brukes til utdyping av maling og opacifier i emaljer. De brukes også i Bermellón, gule og oransje pigmenter, som er produkter med langsom oksidasjon av antimon sulfider.
Noen av dens organiske salter (tartratos) brukes i tekstilindustrien for å hjelpe i koblingen til visse fargestoffer.
Antimon sulfid ble brukt i det gamle Egypt som kosmetisk i mørkere øyne.
Andre bruksområder
Noen antimonalsalter brukes som beleggemidler for å eliminere mikroskopiske bobler som dannes på TV -skjermer. Antimonioner samhandler med oksygen, og eliminerer deres tendens til å danne bobler.
Antimon sulfid (III) brukes i hodene til noen sikkerhetskamper. Antimon sulfid brukes også i stabiliseringen av friksjonskoeffisienten til materialene som brukes i bilbremseklosser.
Isotopen 124SB, sammen med Beryllium, brukes som kilde til nøytroner, med et energis gjennomsnitt på 24 keV. I tillegg brukes antimon som en katalysator i plastproduksjon.
Risiko
Det er et sprøtt element, slik at et miljøgifterpulver kan oppstå under manipulasjon. Hos arbeidere som er utsatt for antimonstøv, er dermatitt, renitt, betennelse i høye luftveier og konjunktivitt observert.
Pneumokoniose er blitt beskrevet, noen ganger kombinert med hindrende lungeforandringer, etter langvarige utstillinger.
Antimon trioksid kan forårsake skade på hjertefunksjonen som kan være dødelig.
Hos personer utsatt for dette elementet har tilstedeværelsen av pustulære hudinfeksjoner blitt observert, av en forbigående karakter.
Kontinuerlig inntak av lav dose av dette metallet kan forårsake diaré oppkast og magesår. Også den maksimale tålelige konsentrasjonen i luften er 0,5 mg/m3.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Manny. (11. mars 2009). Gult antimon og eksplosivt antimon. Hentet fra: AntimonProperties.Blogspot.com
- Prof. Ernst Cohen og J. C. Van Den Bosch. (1914). Allotropien av antimon. Prosedyrer Royal Acad. Amsterdam. Vol. Xvii.
- Wikipedia. (2019). Antimon. Hentet fra: i.Wikipedia.org
- Advameg, inc. (2019). Antimon. Gjenopprettet fra: ChemistryExplaed.com
- Mc'oneal Saber. (15. september 2018). Kjemi: Egenskaper og anvendelse av SB-Antimon. Gjenopprettet fra: Medium.com
- « Biogeografisk historie, hvilke studier og forskningseksempler
- Auditiv forurensningsårsaker, konsekvenser, løsninger »

