Anthraceno hva er, struktur, egenskaper, bruker
- 4390
- 152
- Theodor Anders Hopland
Han Antracen Det er en polysyklisk aromatisk hydrokarbon (PAH) som dannes ved fusjon av tre benzenringer. Det er en fargeløs forbindelse, men under bestråling av ultrafiolett lys tilegner en lysstoffrør en lysrør. Antracenen sublimer lett.
Det er et hvitt fast stoff, men det kan også forekomme som ukoliniske fargeløse krystaller, av en myk aromatisk lukt. Den faste antracen er praktisk talt uoppløselig i vannet og er delvis oppløselig i organiske løsningsmidler, spesielt i karbondisulfid, CS2.
Det ble oppdaget i 1832 av August Laurent og Jean Dumas, ved å bruke tjæren som råstoff. Dette materialet fortsetter å brukes i antracenproduksjon, siden det inneholder 1,5 % av den aromatiske forbindelsen. Det kan også syntetiseres fra benzokinon.
Det finnes i miljøet som et produkt av delvis forbrenning av fossile hydrokarboner. Det er funnet i drikkevann, i den atmosfæriske luften, i rømmingene til motorvogner og i røyk fra sigarettene. Vises på EPA -listen (USAs miljøvernbyrå) av viktigste miljøforurensninger.
Anthracen struktur
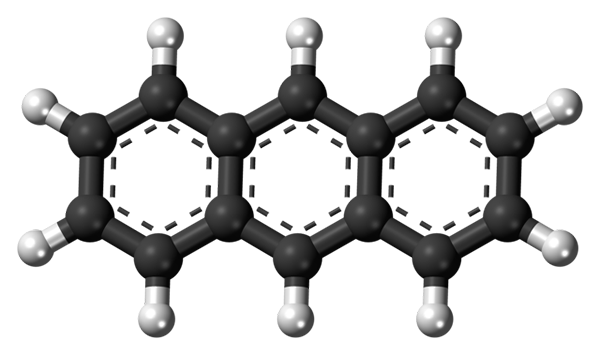 De tre aromatiske ringene av antracen. Kilde: Jynto [CC0]
De tre aromatiske ringene av antracen. Kilde: Jynto [CC0] Det øvre bildet viser strukturen til antracen representert med en kuler og barer -modell. Som det kan sees, er det tre aromatiske ringer med seks karboner; Dette er benzenringer. De stiplede linjene indikerer aromatisiteten som er til stede i strukturen.
Alle karbonatomer har SP -hybridisering2, Så molekylet er i samme plan. Derfor kan antracen betraktes som et lite og aromatisk ark.
Merk at hydrogenatomer (hvite kuler) blir praktisk talt oppdaget foran en serie kjemiske reaksjoner.
Intermolekylære krefter og krystallinsk struktur
Anthracen. For eksempel kan du se at to av disse "arkene" blir med og flytter elektronene til π -skyen deres (de aromatiske sentrene til ringene), de klarer å holde sammen.
En annen mulig interaksjon er at hydrogener, med en viss positiv delvis belastning, blir tiltrukket av de negative og aromatiske sentre for nabolandet antract -molekyler. Og derfor utøver disse attraksjonene en retningsbestemt effekt som veileder antracenmolekyler i verdensrommet.
Kan tjene deg: hastighet konstantDermed bestilles antracen på en slik måte at det vedtar et langrangeringsstrukturmønster; Og derfor kan det krystallisere i et monoklinisk system.
Antagelig viser disse krystallene gulaktige fargeleggsprodukt av deres oksidasjon til Antraquinona; som er en avledet fra antracen hvis faste er gult.
Egenskaper
Kjemiske navn
-Antracen
-Paranaftalene
-Anthracin
-Grønn olje
Molekylær formel
C14H10 eller (c6H4CH)2.
Molekylær vekt
178,234 g/mol.
Fysisk beskrivelse
Hvit eller blekgult faststoff. Monokliniske krystaller produkt av omkrystallisering i alkohol.
Farge
Når det er rent, er antracen fargeløs. Med gule lys gir gule krystaller fluorescens av en blå farge. Du kan også presentere visse gulaktige toner.
Lukt
Myk aromatisk.
Kokepunkt
341.3 ºC.
Smeltepunkt
216 ºC.
tenningspunkt
250 ºF (121 ºC), lukket kopp.
Vannløselighet
Praktisk talt uoppløselig i vann.
0.022 mg/l vann ved 0 ºC
0044 mg/l vann ved 25 ºC.
Etanolløselighet
0,76 g/kg ved 16 ºC
3,28 g/kg ved 25 ° C. Merk hvordan er mer løselig i etanol enn i vann ved samme temperatur.
Løselighet i Hexano
3,7 g/kg.
Løselighet i benzen
16.3 g/l. Hans største løselighet i benzen viser hans høye affinitet for ham, siden begge stoffene er aromatiske og sykliske.
Karbondisulfidløselighet
32,25 g/l.
Tetthet
1.24 g/cm3 ved 68 ºF (1,25 g/cm3 ved 23 ºC).
Damptetthet
6,15 (med luften tatt som en referanse lik 1).
Damptrykk
1 mmHg ved 293 ºF (Sublima). 6.56 x 10-6 MMHG ved 25 ºC.
Stabilitet
Det er stabilt hvis det er lagret under de anbefalte forholdene. Det er triboluminescerende og triboelektrisk; Dette betyr at det avgir lys og strøm når den gnir. Antracen mørkner når det blir utsatt for sollys.
Selvretning
1.004 ºF (540 ºC).
Nedbrytning
Farlige forbindelser ved forbrenning (karbonoksider) produseres. Den dekomponerer når den varmes opp under påvirkning av sterke oksidanter, og produserer en dekar og giftig røyk.
Det kan tjene deg: Nitrobenzen (C6H5N2): Struktur, egenskaper, bruksområder, risikoForbrenningsvarme
40,110 kJ/kg.
Kalorikapasitet
210,5 J/mol · K.
Maksimal absorpsjonsbølgelengde (synlig lys og ultrafiolett)
Maksimal λ 345,6 nm og 363,2 nm.
Goo
-0,602 CPOISE (240 ºC)
-0.498 CPOISE (270 ºC)
-0.429 CPOISE (300 ° C)
Som det kan sees, avtar viskositeten når temperaturen øker.
Nomenklatur
Antracen er et ensartet polysyklisk molekyl, og i henhold til nomenklaturen som er etablert for denne typen system, bør dets virkelige navn være Tricen. TRI -prefikset skyldes at det er tre beanceniske ringer. Imidlertid har det trivielle navnet antracen utvidet og forankret i populær og vitenskapelig kultur.
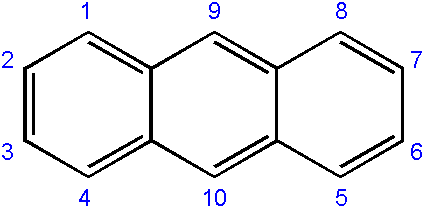
Nomenklaturen til forbindelsene avledet fra den er vanligvis noe sammensatt, og avhenger av karbonet der erstatning skjer. Følgende viser den respektive nummereringen av karbonatomer for Anthract:
 Antall karbonatomer i antracen. Kilde: Edgar181 [Public Domain]
Antall karbonatomer i antracen. Kilde: Edgar181 [Public Domain] Nummereringsrekkefølgen skyldes prioriteten i reaktivitet eller mottakelighet av nevnte karbonatomer.
Karbonene i endene (1-4 og 8-5) er de mest reaktive, mens de i midten (9-10) reagerer gjennom andre forhold; For eksempel oksidativt, for å danne antraquinon (9, 10-dioxontracene).
Toksisitet
I kontakt med huden kan det forårsake irritasjon, kløe og svie, noe som forverres med sollys. Antracen er fotosensibilisator, noe som forbedrer hudskadene forårsaket av UV -stråling. Det kan forårsake akutt dermatitt, teangiectasia og allergi.
I kontakt med øynene kan det forårsake irritasjon og brenne. Pusteantracen kan irritere nesen, halsen og lungene, forårsake hoste og tungpustethet.
Antraceninntak har vært assosiert hos mennesker med hodepine, kvalme, tap av matlyst, betennelse i mage -tarmkanalen, langsomme reaksjoner og svakhet.
Det har vært forslag om en krefthandling av antracen. Imidlertid har denne formodningen ikke blitt bekreftet, inkludert noen anthracen -derivater har blitt brukt i behandlingen av visse typer kreft.
applikasjoner
Teknologisk
-Antracen er en organisk halvleder, brukt som en spinder i høy -energi -fotoner, elektroner og alfapartikler.
-Det brukes også til plastbelegg, for eksempel polyviniltoluen. Dette for å produsere plastspindler, med vannlignende egenskaper, å bruke det i strålebehandlingsdosimetri.
Det kan tjene deg: piperidin: struktur, syntese, derivater, reaksjoner-Antracen brukes ofte som en UV -strålingsplotter, påført i belegg i trykte kretskort. Dette gjør det mulig å inspisere fôret med ultrafiolett lys.
Frittstående molekyl
I 2005 syntetiserte kjemikerne ved University of California, Riverside, det første standardmolekylet: 9.10-ditiOantratone. Dette skyves i en rett linje når den varmes opp på en flat kobberoverflate, og kan bevege seg som om den hadde to meter.
Forskerne trodde at molekylet potensielt var brukbart i molekylær databehandling.
Piezokromatikitet
Noen antracenderivater har piezokromatiske egenskaper, det vil si at de har muligheten til å endre farge avhengig av trykket som brukes. Derfor kan de brukes som trykkdetektorer.
Antracen brukes også til utdyping av de såkalte røykskjermene.
Økologisk
Politiske aromatiske hydrokarboner (PAH) er miljøgifter, hovedsakelig fra vann, så det arbeides for å redusere den giftige tilstedeværelsen av disse forbindelsene.
Antracen er et materiale (PAH) og brukes som modell for å studere anvendelsen av vannpyrolysemetoden i nedbrytningen av PAH -forbindelser.
Vannpyrolyse brukes i industriell vannbehandling. Handlingen på antracen produserte dannelsen av oksidasjonsforbindelser: Antron.
Disse produktene er mindre stabile enn antracen, og derfor er de mindre vedvarende i miljøet, og kan lettere bli eliminert enn PAH -forbindelser.
Andre
-Antracen oksiderer for å opprinnelig anthrokinon, brukt i syntesen av fargestoffer og fargestoffer
-Antracen brukes i trebeskyttelse. Det brukes også som et insektmiddel, hjerneslag, ugressmiddel og ratikid.
-Antracycline antibiotika har blitt brukt i cellegift, siden det hemmer syntesen av DNA og RNA. Antracyklinmolekylet er ispedd DNA/RNA -basene, og hemmer replikasjonen av raskt voksende kreftceller.
Referanser
- Antracen. Hentet fra: i.Wikipedia.org
- Antracen. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov

