Arsen trioksid (AS2O3)
- 2295
- 697
- Jonathan Carlsen
Han Arsen trioksid Det er en uorganisk forbindelse hvis kjemiske formel er slik2ENTEN3. Arsen i sin metalliske tilstand blir raskt transformert til dette oksidet, som er en veldig giftig gift som kan ha akutte og kroniske manifestasjoner.
Å være arsen og oksygenelementer i blokk P, med en relativt lav elektronegativitetsforskjell, er esset forventet2ENTEN3 være sammensatt av en kovalent natur; det vil si at AS-O-bindingene dominerer i deres faste stoff, på elektrostatiske interaksjoner mellom essionene3+ Jeg2-.
Akutt forgiftning med arsen trioksid produseres ved inntak eller inhalasjon, og er de viktigste manifestasjonene av dette: sterke gastrointestinale lidelser, kramper, sirkulasjons kollaps og lungeødem.
Til tross for dens toksisitet, har den imidlertid blitt brukt industrielt; For eksempel ved bevaring av tre, i utdyping av pigmenter, halvledere, etc. På samme måte ble den tidligere brukt i behandlingen av mange sykdommer.
Arsen trioksid er en amfoterisk forbindelse, oppløselig i syrer og fortynnet alkalier, uoppløselig i organiske løsningsmidler og relativt oppløselig i vann. Det presenteres som et solid (overlegen bilde), med to krystallinske former: kubikk og monoklinisk.
Arsen trioksidstruktur
Claudetita
Ved romtemperatur, esset2ENTEN3 Krystalliserer i to monokliniske polymorfer, begge funnet i Claudetita -mineralet. I dem er det trigonale pyramideenheter ASO3, som binder av oksygenatomer for å kompensere for enheten elektronisk mangel alene.
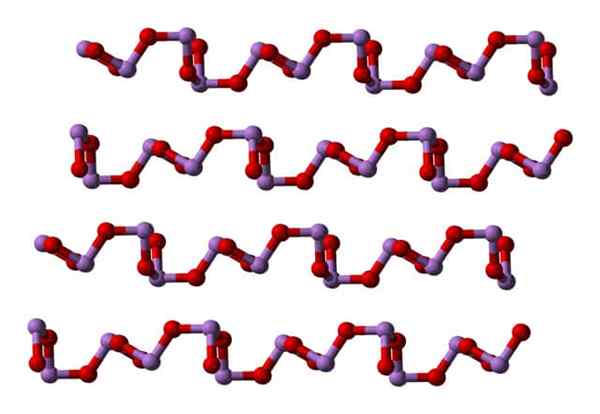
I en polymorf ASO -enhetene3 De er koblet til å danne rader (Claudetita I), og i den andre er de koblet som om de vevet et nettverk (Claudetita II):
Kan tjene deg: agglomerant materialer Claudetita polymorfo struktur i. Kilde: Ben Mills [Public Domain].
Claudetita polymorfo struktur i. Kilde: Ben Mills [Public Domain].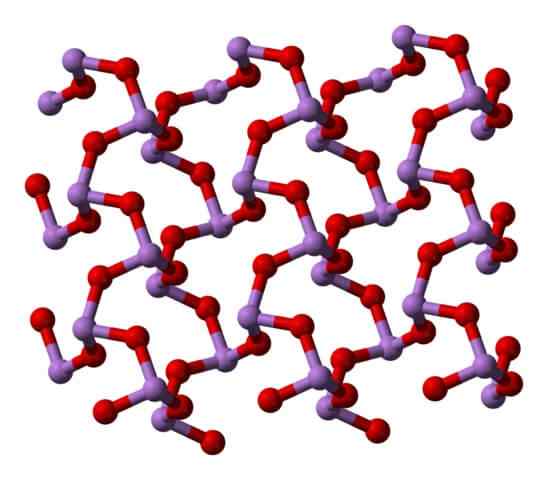 Claudetita polymorfo struktur II. Kilde: Ben Mills [Public Domain].
Claudetita polymorfo struktur II. Kilde: Ben Mills [Public Domain].
Flytende og gassformig
Når alle disse strukturene som definerer monoklinkrystaller blir oppvarmet, er vibrasjonene slik at flere AS-O-koblinger er ødelagte, og ender opp med å være et mindre molekyl:4ENTEN6. I det nedre bildet vises strukturen.
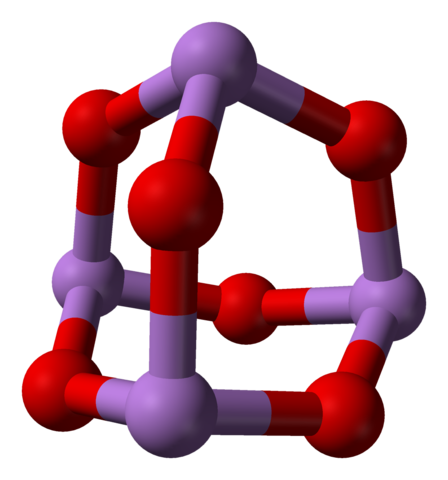 AS4O6 -molekyl. Kilde: Ben Mills [Public Domain]
AS4O6 -molekyl. Kilde: Ben Mills [Public Domain] Det kan sies at det består av en dag av som2ENTEN3. Stabiliteten er slik at den støtter 800 ° C i en gassfase; Men over denne temperaturen er den fragmentert i som molekyler2ENTEN3.
Arsenolitt
Det samme som4ENTEN6 kan samhandle med hverandre for å krystallisere i et kubikk faststoff, hvis struktur finnes i arsenolittmineralet.
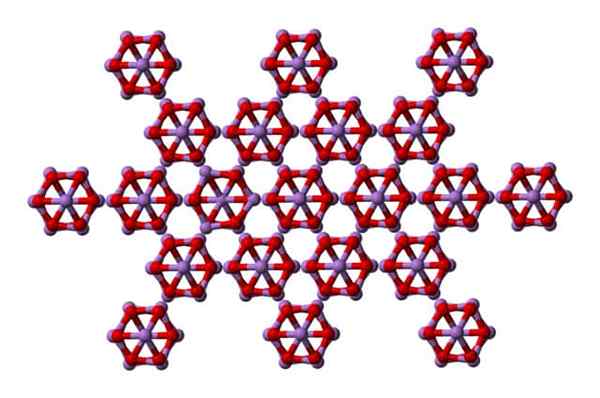 AS4O6 -molekyler i arsenolittfast. Kilde: Ben Mills [Public Domain]
AS4O6 -molekyler i arsenolittfast. Kilde: Ben Mills [Public Domain] Merk at på bildet vises strukturen fra et høyere plan. Sammenlignet med claudetita, er dens strukturelle forskjell med arsenolitt tydelig. Her er de diskrete molekyler4ENTEN6 at enhetene opprettholdes av van der Waals styrker.
Egenskaper
Handelsnavn
-Arsenolitt
-Arsodent
-Trisenox
-Claudetita
Molekylær vekt
197,84 g/mol.
Fysisk utseende
-Hvite kubikkkrystaller (arsenolitt).
-Monokliniske fargeløse krystaller (Claudetita).
-Hvitt eller gjennomsiktig fast, glassaktig, amorfe klumper eller krystallinsk støv.
Lukt
Toalett.
Smak
Smakløs.
Kokepunkt
460 ºC.
Smeltepunkt
-313 ºC (Claudetita).
-274 ºC (Arsenolite).
tenningspunkt
485 º C (Sublima).
Vannløselighet
17 g/l a 18 ºC (20 g/l a 25 ºC).
Løselighet
Syreoppløselig (spesielt i saltsyre) og alkalier. Praktisk talt uoppløselig i kloroform og eter.
Kan tjene deg: sentrifugeringTetthet
-3,85 g/cm3 (kubikkkrystaller);
-4.15 g/cm3 (Rhombic Crystals).
Damptrykk
2,47 · 10-4 MMHG ved 25 ºC.
Nedbrytning
Det er ikke drivstoff, men på grunn av oppvarming kan det forårsake giftig røyk som kan omfatte Arsina.
Korrosivitet
I nærvær av fuktighet kan det være etsende for metaller.
Fordampningsvarme
77 kJ/mol.
Dissosiasjonskonstant (Ka)
1.1 · 10-4 ved 25 ºC.
Brytningsindeks
-1 755 (Arsenolite)
-1.92-2.01 (Claudetita).
Reaktivitet
-Arsen trioksid er en amfoterisk forbindelse, men den fungerer helst som syre.
-Den kan reagere med saltsyre eller med fluorhorisk syre, og danner arsen triflourid eller arsen triflourur.
-Den reagerer også med sterke oksidanter, for eksempel salpetersyre, forårsaker arseninsyre og lystgass.
-Arsen trioksid kan reagere med salpetersyre, produsere arsin eller arsenelement, avhengig av reaksjonsbetingelsene.
Ess2ENTEN3 + 6 Zn +12 HNO3 => 2 aske3 + 6 Zn (nei3)2 + 3 H2ENTEN.
Denne reaksjonen fungerte som et grunnlag for å opprette Marsh -testen, brukt til påvisning av arsenforgiftning.
Nomenklatur
På2ENTEN3 Det kan utnevnes i henhold til følgende nomenklinger, vel vitende om at Arsen fungerer med Valencia +3:
-Arsenioso oksid (tradisjonell nomenklatur).
-Arsenoksid (iii) (Stock Nomenclature).
-Diarsen trioksid (systematisk nomenklatur).
applikasjoner
Industriister
-Det brukes til fremstilling av glass, spesielt som fadingmiddel. Det brukes også til utdyping av keramikk, elektroniske produkter og fyrverkeri.
-Det legges til som en mindre komponent til kobberbaserte legeringer, for å øke korrosjonsmotstanden til legeringsmetaller.
-AS2ENTEN3 Det er startmaterialet for fremstilling av elementær arsen, å forbedre elektriske ledd, og for utdyping av Arsenuros -halvledere
Det kan tjene deg: Nukleær kjemi: Historie, studieretning, områder, applikasjoner-AS2ENTEN3, I tillegg til kobberarseniato, brukes de som konserveringsmidler. Det ble brukt i kombinasjon med kobberacetat for utdyping av det grønne pigmentet i Paris, brukt i utdyping av malerier og ratikider.
Leger
-Arsen trioksid er en forbindelse som har blitt brukt i århundrer i behandlingen av mange sykdommer. Det ble brukt som tonic i behandlingen av ernæringsforstyrrelser, nevralgi, revmatisme, leddgikt, astma, Korea, malaria, syfilis og tuberkulose.
-På samme måte har det blitt brukt i lokal behandling av hudsykdommer, og brukes til å ødelegge noen overfladiske epiteliomer.
-Fowlers løsning ble brukt i behandling av hudsykdommer og leukemi. Bruken av denne medisinen blir avviklet.
-På 1970 -tallet utviklet den kinesiske forskeren Zhang Tingdong en undersøkelse om bruken av arsen trioksid i behandlingen av akutt promielocytisk leukemi (APL). Noe som førte til produksjon av Trisenox -medikamentet, som ble godkjent av USAs FDA.
-Trisenox har blitt brukt hos PLA -pasienter som ikke reagerer på behandlingen av "første linje", bestående av all transsyresyre (ATTRA). Det har blitt vist at arsen trioksid får kreftceller til å lide apoptose.
-Trisenox brukes som en cytostatisk i behandlingen av ildfast promiselocytisk subtype (m3) av appen.
Referanser
- Arsen trioksid. Sevier. Hentet fra: Scientedirect.com
- Arsen (iii) oksid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov

