Asparaginegenskaper, struktur, funksjoner, biosyntese
- 4446
- 1300
- Prof. Joakim Johansen
De Asparagina (ASN eller N) er en viktig aminosyre for cellesignalering og foreningen mellom proteiner og karbohydrater. Dette er en av de 22 basiske aminosyrene og er katalogisert som ikke -essensiell, ettersom det syntetiseres av pattedyrens kropp.
Denne aminosyren er klassifisert i gruppen av polare aminosyrer uten belastning og var den første nakne aminosyren, et faktum som skjedde i 1806, hvor den ble isolert fra aspargesjuicen (en slags urteaktig plante) av de franske kjemikaliene vauquelin og Robiquet.
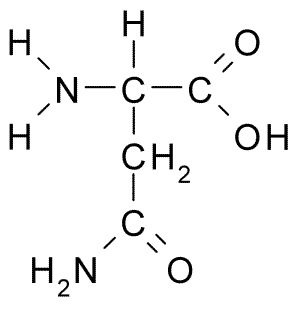
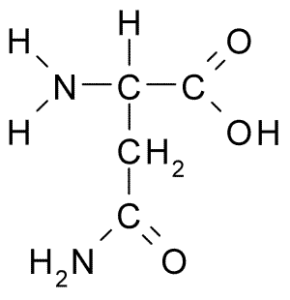 Kjemisk struktur av aminosyre asparagin (kilde: borb, via wikimedia commons)
Kjemisk struktur av aminosyre asparagin (kilde: borb, via wikimedia commons) Til tross for sin tidlige oppdagelse, ble ikke den biologiske og ernæringsmessige rollen til asparagin gjenkjent, men mer enn 100 år senere da dens tilstedeværelse i 1932 i strukturen til et protein som var til stede i hampfrøene ble bekreftet.
Asparagin og glutamin fungerer som underlag for midtgruppene på to veldig hyppige aminosyrer i proteiner: aspartisk (asparaginsyre) og glutamat (glutaminsyre), henholdsvis. Asparagin og glutamin hydrolyseres lett i disse aminosyrene ved enzymatisk virkning eller syre og basiske forbindelser.
Mange protease -serinenzymer som er ansvarlige for hydrolyserende peptidbindinger har aspargin i sidekjeden til sitt aktive sted. Denne resten har en negativ delvis belastning og er ansvarlig for å bli med på en utfyllende måte med den positive belastningen på de hvite peptidene, og nærmer seg skjærestedet.
Enzymet som har ansvaret for oksalacetatsyntesen fra asparagin brukes i kjemoterapeutiske behandlinger og er kjent som L-asparaginase, som er ansvarlig for å katalysere den hydrolytiske fragmenteringen av AMIDA av asparagin til aspartat og ammonium.
Asparaginase blir overuttrykt og renset fra Escherichia coli, Som skal injiseres hos barns pasienter som har akutt lymfoblastisk leukemi, siden både normale og ondartede lymfocytter avhenger av fangst av asparagin i blodet for vekst og multiplikasjon.
[TOC]
Egenskaper og struktur
Alle de kjemiske strukturene til aminosyrene har en karboksylgruppe (-coh), en aminogruppe (-NH3+), et hydrogen (-H) og en R- eller Substituent-gruppe som er forent av det samme sentrale karbonatom, kjent som karbon α.
Aminosyrer skiller seg fra hverandre med identiteten til sidekjedene deres, som er de som er kjent som R -grupper, og som kan variere i størrelse, struktur, funksjonelle grupper og til og med elektrisk ladning.
Karbonatomer av R -grupper identifiserer seg med bokstaver fra det greske alfabetet. Når det.
Kan tjene deg: Agar XLD: Foundation, Preparation and UsesI henhold til en annen type nomenklaturer er karbonatom i karboksylgruppen (-Coh) oppført som C-1, så fortsetter med nummereringen, ville karbon α være C-2 og så videre.
Et asparaginmolekyl har fire karbonatomer, inkludert karbon α, karboksylgruppe karbon og to karbonatomer som er en del av R-gruppen, kjent som karboksamid (-Ch2-Co-Co-NH2).
Denne karboksamidgruppen finnes bare i to aminosyrer: i asparagin og glutamin. Det har karakteristikken at den kan danne hydrogenbroer med stor letthet gjennom aminogruppen (-NH2) og karbonylgruppen (-CO).
Klassifisering
Asparagin tilhører gruppen av polare aminosyrer uten belastning, som er veldig oppløselige aminosyrer i vann og veldig hydrofil (på grunn av deres dannelseskapasitet for flere hydrogenbroer).
I gruppen av polare aminosyrer uten belastning er også serin, treonin, cystein og glutamin. Alle disse er forbindelser "Zwitterionics”, Siden de har en polar gruppe i R -kjeden som bidrar med nøytraliseringen av lastene.
Alle polare aminosyrer uten belastning er ikke ioniserbare i pH nær 7 (nøytral), det vil si at de ikke har positive eller negative ladninger. I sure og grunnleggende medier blir imidlertid substituenter ionisert og får en byrde.
Stereokjemi
Det sentrale karbonet eller α -karbonet i aminosyrene er et chiralt karbon, da har det fire forskjellige forente substituenter, som forårsaker minst to skillelige stereoisomerer for hver aminosyre.
Stereoisomerer er spekulære bilder av et molekyl som har den samme molekylære formelen, men er ikke superponerbare med hverandre, for eksempel hender (venstre og høyre). De er betegnet med bokstaven D eller L, siden eksperimentelt er løsningene av disse aminosyrene roter det polariserte lysplanet i motsatte retninger.
Den generelle asymmetrien av aminosyrer gjør stereokjemien til disse forbindelsene av stor betydning, siden hver enkelt har forskjellige egenskaper, syntetiseres og deltar i forskjellige metabolske ruter.
Asparagin kan finnes i d-asparagin- eller l-asparaginform, sistnevnte er den hyppigste i naturen. Det syntetiseres ved L-synthesase og metabolisert for L-asparaginase, begge enzymer er veldig rikelig i virveldyret.
Funksjoner
Lettelsen av å danne asparaginhydrogenbroer gjør det til en avgjørende aminosyre for strukturell stabilitet av proteiner, siden den kan danne indre hydrogenbroer med laterale kjedene til de andre aminosyrene som gjør dem opp.
Kan tjene deg: 25 eksempler på aseksuell reproduksjonAsparagin finnes vanligvis på overflaten av typiske vandige medier, og stabiliserer strukturen.
Mange glykoproteiner kan binde seg til karbohydrater eller karbohydrater gjennom en asparagin, treonin eller serinrest. Når det.
Det er viktig å fremheve at karbohydrater i alle N-glykosylerte glykoproteiner binder seg til disse gjennom en asparaginrest som er i en spesifikk region betegnet som ASN-X-ser/thr, der x er hvilken som helst aminosyre.
Disse glykoproteinene er samlet i endoplasmatisk retikulum, der de er glykosylert når de er oversatt.
Biosyntese
Alle eukaryote organismer assimilerer ammoniakk og transformerer det til glutamat, glutamin, karbamil-fosfat og asparagin. Asparagin kan syntetiseres fra glykolytiske mellommenn, i sitronsyresyklusen (fra oksalacetat) eller fra forløperne som konsumeres i kostholdet.
Syntetase asparaginenzym er en amidotransferase avhengig av glutamin og ATP at ATP og uorganisk pyrofosfat (PPI) spytter og bruker ammoniakk eller glutamin for å katalisere en amidasjonsreaksjon og konvertere aspartatet til asparagin.
Både bakterier og dyr har en syntetase asparagin, men i bakterier bruker enzymet ammoniumionet som nitrogendonor, mens i pattedyr bruker syntetiske synthesase glutamin som hoveddonor i nitrogengruppen.
Det enzymatiske bruddet av ATP til AMP og uorganisk pyrofosfat (PPI), sammen med glutamin som en giver av AMIDA-gruppen, er de viktigste forskjellene med hensyn til biosyntesen av L-glutamin mellom de forskjellige organismer.
Nedbrytning
De fleste studier på asparaginmetabolisme er blitt utført i planter, med tanke på det faktum at studier i pattedyr ble hindret av mangelen på metodologier som er følsomme nok for aminosyretester på nivået med mer komplekse systemer.
L-asparagin hydrolyseres kontinuerlig hos pattedyr ved L-asparaginase for å forårsake asparaginsyre og ammonium. Det brukes til syntese av glykoproteiner og er en av hovedforløperne for oksalacetat for sitronsyresyklusen.
Asparaginase-enzym katalyserer asparaginhydrolyse til aspartat, deretter aspartat transaminert med a-cetoglutarat for å produsere glutamat og oksalacetatatatatatatatatatatat for å produsere glutamat og oksalacetat.
Kan tjene deg: epiblastSyntheta asparagin, også kjent som aspartat-amoniaco ligase, finnes rikelig av pattedyrhjerneceller.
Når lave nivåer av dette enzymet oppfattes i kroppen, dannes det som kalles "aminoacidopatier", da forløpersubstrater akkumuleres i cytoplasma av hjerneceller.
Mat rik på asparagin
Personer som har akutt lymfoblastisk leukemi har vanligvis mangler med hensyn til syntetase asparaginenzym og er avhengige av asparagin i omløp, så de anbefales et kosthold i mat som er rik på asparagin eller den eksogene tilførselen av det samme.
Blant de flere matvarene med høyt asparagininnhold er hun.
Det er L-asparagine konsentrater som er formulert for idrettsutøvere med høy konkurranse, siden forbruket deres hjelper til med å regenerere proteinene som utgjør vevet.
I tillegg inntar personer som har underskudd i aminosyresyntese også disse tablettene for å unngå lidelser i sentralnervesystemet.
Asparagin er lettere å metabolisere gjennom sin L-asparaginform, siden mange av enzymene som er involvert i stoffskiftet ikke gjenkjenner D-asparaginformen, og derfor er ikke all asparagin inntatt i mat tilgjengelig for forskjellige organismeprosesser.
Det rikelig asparagininntaket kan være gunstig, men det anbefales ikke.
Referanser
- Cooney, d. TIL., Capizzi, r. L., & Handschumacher, r. OG. (1970). Evaluering av L-asparagin metabolisme i anims og mann. Kreftforskning, 30 (4), 929-935
- Dunlop, p. C., Roon, r. J., & Til og med, h. L. (1976). Bruk av D-asparagin av Saccharomyces cerevisiae. Journal of Bacteriology, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, f. (2017). Fremskritt innen asparagin metabolisme. I Fremgang i botanikk Vol. 79 (s. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, S. (1985). Montering av asparginbundne oligosakkarider. Årlig gjennomgang av biokjemi, 54 (1), 631-664
- Mathews, c. K., & Ahern, K. G. (2002). Biokjemi. Pearson Education.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger prinsipper for biokjemi. Macmillan.
- Yamada, k., Hashizume, d., Shimizu, t., & Yokoyama, s. (2007). L-asparagin. Krystallografisk handling Avsnitt E: Strukturrapporter online, 63 (9), 3802-3803.

