Benzenhistorie, struktur, egenskaper, derivater, bruk

- 2657
- 590
- Jonathan Moe
Han Benzen Det er en organisk forbindelse som består av en av de enkleste aromatiske hydrokarbonene. Dens kjemiske formel er C6H6, hvorav det er kjent at forholdet mellom karbon og hydrogen er lik 1; det vil si for hvert karbon er det et hydrogen knyttet til dette.
Selv om dets fysiske utseende er en fargeløs væske, finnes den naturlig i olje og produkter avledet fra den. Lukten er veldig karakteristisk, da den ligner en blanding av lim, bitumen og bensin; På den annen side er det en flyktig og brennbar væske.
 Belfing med benzen. Kilde: Air1404 [CC av 4.0 (https: // creativecommons.Org/lisenser/av/4.0)]
Belfing med benzen. Kilde: Air1404 [CC av 4.0 (https: // creativecommons.Org/lisenser/av/4.0)] I det øvre bildet vises en beholder eller flaske med benzen, antagelig av ikke -analytisk renhet. Hvis benzendampene umiddelbart blir avdekket i hele laboratoriet. Av denne grunn blir denne væsken, ofte brukt som et enkelt løsningsmiddel, manipulert inne i en gassavtrekkklokke.
Å være din formel C6H6, Kjemikaliene fra det nittende århundre hevet mange mulige strukturer som tilsvarer nevnte andel C/H lik 1. Ikke bare dette, men benzenmolekylet måtte ha spesielle koblinger på en slik måte at dens uvanlige stabilitet kunne forklares til tilsetningsreaksjonene; Typisk for alkener og retningslinjer.
Det var slik at koblingene hans representerte en gåte for kjemikaliene på den tiden; Til eiendommen ringte aromatisitet. Før betraktet som en hexacyclotrien (med tre bindinger c = c), er benzen mye mer enn det, og det er et av de mange eksemplene på synergi i kjemi.
I organisk kjemi er benzen et klassisk symbol, strukturelt grunnlag for flere polylaromatiske forbindelser. Fra dens sekskant oppnås symfiner av derivater via aromatisk elektrofil substitusjon; En ring hvis kanter grenser til strukturen som definerer nye forbindelser.
Faktisk skyldes derivater den enorme industrielle bruksområder for de som trenger benzen blant råstoffene sine. Fra fremstilling av tekstillim og fibre, til plast, gummi, pigmenter, medisiner og eksplosiver. På den annen side finnes naturlig benzen i vulkaner, skogbranner, bensin og i røyk fra sigarettene.
[TOC]
Historie
Oppdagelse og navn
Oppdagelsen hans stammer fra 1825, normalt tildelt Michael Faraday, da han samlet og gjorde eksperimenter med et gjenværende oljeprodukt av gassen som ble brukt til belysning. Denne væsken inneholdt en andel C/t nær 1, og det er grunnen til at den kalte den 'forgasset hydrogen'.
Kjemikeren Auguste Laurent utnevnte den rare hydrokarbon 'feno', avledet fra det greske ordet 'Phaínein'Hva betyr strålende (fordi det ble oppnådd etter at gassen brant). Dette navnet ble imidlertid ikke akseptert av det vitenskapelige samfunnet og seiret bare som 'fenyl', for å referere til det radikale avledet fra benzen.
Fra benzoin -gummien klarte kjemikeren Eilhard Mitscherlich, ni år senere, å produsere den samme forbindelsen; Det var derfor en annen kilde for det samme hydrokarbonet, som han døpte som 'Benzina'. Imidlertid vurderte de heller ikke det aktuelle navnet for å anta at det var en alkaloid, for eksempel kinin.
Dermed erstattet de navnet 'Bencina' med 'Benzol'. Imidlertid var det motsetninger og avvik igjen fordi begrepet 'benzol' forvirret hydrokarbon for en alkohol. Det var da navnet 'Benzen' ble født, brukt først i Frankrike og England.
Det kan tjene deg: litiumkarbonat (Li2CO3): Struktur, egenskaper, brukIndustriell produksjon
Verken lysgass eller benzoingummi var passende kilder for å generere benzen til store skalaer. Charles Mansfield, som jobber med August Wilhelm von Hofmann, oppnådde i 1845 benzen (tjue år etter oppdagelsen) av Hulla Tar, laterale produkt av koksproduksjonen.
Dermed begynte den industrielle produksjonen av benzen fra Hulla Tar. Tilgjengeligheten av benzen i massive mengder, letter studiet av dens kjemiske egenskaper og lot den relatere den til andre forbindelser med lignende reaktiviteter. August Wilhelm von Hofmann myntet ordet 'aromatisk' for benzen og relaterte forbindelser.
Historiske strukturer
August Kekulés drøm
Friedrich August Kekulé tildeles den sekskantede og sykliske strukturen i benzen rundt 1865, som oppstår fra en merkelig drøm med Uroboros, slangen som biter sin egen hale ved å tegne en sirkel. Dermed mente han at benzen kunne betraktes som en sekskantet ring, og andre kjemikalier hevet mulige strukturer, som er vist nedenfor:
 Benzenringstrukturer foreslått gjennom historien. Kilde: Jü [Public Domain]
Benzenringstrukturer foreslått gjennom historien. Kilde: Jü [Public Domain] Noen av de øvre strukturer kan rettferdiggjøre stabiliteten til benzen.
Bok, ringer og prisme
Merk at den tredje strukturen ikke engang er en ring, men et trekantet prisme, foreslått av Albert Ladenburg i 1869; Til venstre for en åpen bokformet, foreslått av Sir James Dewar i 1867; Og til høyre for seg, en med alle hydrogener rettet mot midten av ringen, foreslått av Henry Edward Armstrong i 1887.
Den første strukturen, foreslått av Adolf Karl Ludwig Claus i 1867, er også ganske særegen, ettersom C-C-koblinger krysses. Og den siste var Kekulés "Serpentine" -ring, drømte i 1865.
Hva var "vinneren"? Den femte strukturen (fra venstre mot høyre), foreslått i 1899 av Johannes Thiele.
I dette ble resonanshybrid for første gang vurdert, som kombinerte de to kekuléstrukturene (snudde den første ringen til høyre for å observere den) og forklarte ekstraordinært flytting av elektronene og, med den, inntil da uvanlig stabilitet av Benzenet.
Benzenstruktur
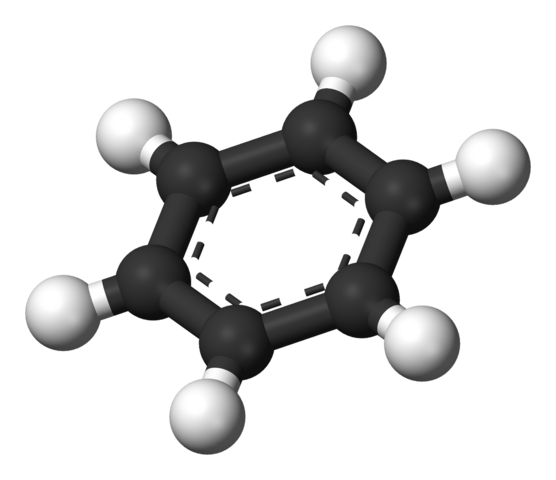 Benzen aromatisk ring. Kilde: Benjah-BMM27 [Public Domain]
Benzen aromatisk ring. Kilde: Benjah-BMM27 [Public Domain] Strukturen foreslått av Thiele vises av en sfærer og bar -modell.
Benzenmolekylet er flatt, med hydrogenatomene som peker ut av sidene av ringen. Alle karbonatomer har SP -hybridisering2, Med en orbital p Tilgjengelig for å etablere det aromatiske systemet der seks elektroner flytter.
Disse Carbonos sp2 De er mer elektronegative enn hydrogener, og derfor fjerner den første elektroniske tettheten til sistnevnte (CSp2Δ--HΔ+). Følgelig har midten av ringen en større konsentrasjon av elektroner enn sidene.
Mer presist kan det aromatiske systemet representeres som en sky eller elektronisk pute utvidet av begge sider av den sekskantede ringen; og i midten, av sidene eller kantene, en elektronisk mangel dannet av hydrogener med positiv delvis belastning.
Takket være denne fordelingen av elektriske ladninger, kan benzenmolekyler samhandle med hverandre gjennom dipol-dipolo-krefter; Atomene hΔ+ De føler attraksjon til det aromatiske sentrum av en nabo ring (under dette vil bli representert).
På samme måte kan aromatiske sentre stables oppå hverandre for å favorisere induksjon av øyeblikkelige dipoler.
Kan tjene deg: AlotropyResonans
 Strukturer og resonanshybrid av benzen. Kilde: Edgar181 av Wikipedia.
Strukturer og resonanshybrid av benzen. Kilde: Edgar181 av Wikipedia. De to kekuléstrukturene vises øverst på bildet, og under dem resonanshybrid. Når de to strukturene skjer igjen og igjen samtidig, er hybriden representert med en sirkel trukket i midten (lik den for en "sekskantet smultring").
Hybridsirkelen er viktig fordi den indikerer den aromatiske karakteren til benzen (og den fra mange andre forbindelser). I tillegg påpeker han at koblingene ikke er så lange som C-C, og heller ikke så kort som C = C; Men lengden deres er mellom begge ender. Dermed regnes ikke benzen som en polyhen.
Ovennevnte er påvist ved måling av lengdene på C-C-koblingene (139 pm) av benzenet, som er litt mer langstrakte enn C-H-bindingene (kl. 10.00).
Krystaller
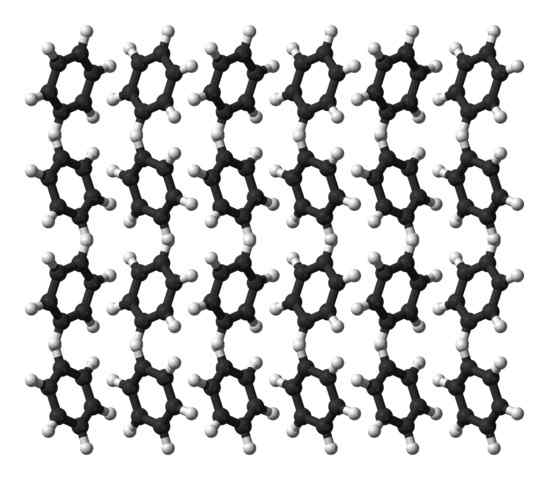 Benzen Ortorrombisk krystallstruktur. Kilde: Ben Mills [Public Domain]
Benzen Ortorrombisk krystallstruktur. Kilde: Ben Mills [Public Domain] Benzen er en væske ved romtemperatur. Dets intermolekylære krefter gjør, til tross for at de har et slikt uttalt et dipolmoment, kan det holde molekylene sammen i en væske som koker ved 80 ºC. Når temperaturen synker under 5 ºC, begynner benzen å fryse: og dermed oppnås deres tilsvarende krystaller.
Benzenringer kan ta i bruk strukturelle mønstre definert i det faste stoffet. Deres dipoler gjør dem "vippet" til venstre eller høyre, og danner rangeringer som er i stand til å reprodusere med en orthorm ortorrombisk celle. Dermed er benzenkrystaller ortorrombiske.
Legg merke til i det overordnede bildet at når ringene er tilbøyelige til å favorisere interaksjonene mellom hΔ+ og de aromatiske sentrene, nevnt i tidligere underavtaler.
Egenskaper
Molekylmasse
78,114 g/mol.
Fysisk utseende
Fargeløs væske med en lukt som ligner på bensin.
Kokepunkt
80 ºC.
Smeltepunkt
5,5 ºC.
tenningspunkt
-11 ºC (lukket kopp).
Selv -tisningstemperatur
497,78 ºC.
Tetthet
0,8765 g/ml ved 20 ºC.
Løselighet
En liter kokende vann kan knapt løse opp 3,94 g benzen. Hans apolare karakter gjør den praktisk talt uisskelig med vann. Imidlertid er det blandbar med andre løsningsmidler, som etanol, etere, aceton, oljer, kloroform, karbontetraklorid, etc.
Damptetthet
2.8 i luftforhold (det vil si nesten tre ganger mer).
Damptrykk
94,8 mm Hg ved 25 ºC.
Forbrenningsvarme
-3267,6 kJ/mol (for flytende benzen).
Fordampningsvarme
33,83 kJ/mol.
Overflatespenning
28,22 mn/m a 25 ºC.
Brytningsindeks
1 5011 til 20 ºC.
Derivater

Benzenhydrogener kan erstattes av andre grupper eller atomer. Det kan være en eller flere substitusjoner, noe som øker substitusjonsgraden inntil av de seks originale hydrogenene er det noen.
For eksempel Benceno som PH-H, hvor H er noen av sine seks hydrogener. Husker at midten av ringen har større elektronisk tetthet, tiltrekker elektrofiler, som angriper ringen for å erstatte H i en reaksjon kalt aromatisk elektrofil substitusjon (Sear).
Hvis denne H erstattes av en åh, vil ph-OH, fenol være vil ha; erstatte en Cho3, Ph-ch3, Toluen; Hvis det er NH2, PH-NH2, anilin; Eller hvis det er Cho2Ch3, Ph-ch2Ch3, Etylbenzen.
Derivater kan være de samme eller mer giftige enn benzen, eller tvert imot, bli så kompliserte at de blir en ønskelig farmakologisk effekt.
Kan tjene deg: Kalsiumkarbid (CAC2): Struktur, egenskaper, innhenting, brukapplikasjoner
Det er et godt løsningsmiddel for et bredt utvalg av forbindelser, til stede for eksempel i malerier, lakk, lim og belegg.
Det kan også løse opp oljer, fett eller voks, så det har blitt brukt som en essensutløsningsmiddel. Denne egenskapen ble brukt av Ludwig Roselius i 1903 for å koffefatte kaffen, en operasjon som allerede er i bruk på grunn av benzenets toksisitet. På samme måte ble den brukt tidligere for å avfelle metaller.
I en av den klassiske bruken fungerer den ikke som et løsningsmiddel, men som et additiv: øke oktanen av bensin, og erstatte bly for dette formålet.
Benzenderivater kan ha forskjellige bruksområder; Noen tjener som plantevernmidler, smøremidler, vaskemidler, plast, eksplosiver, parfymer, fargestoffer, lim, medisiner, etc. Hvis det i sin struktur er en benzenisk ring, er det ganske sannsynlig at syntesen har forlatt benzen.
Among its most important derivatives are: cumeno, xylene, aniline, phenol (for the synthesis of phenolic resins), benzoic acid (preservative), cyclohexan (for the synthesis of the nilon), nitrobenzene, resorcinol and ethylbenzene.
Nomenklatur
Nomenklaturen til benzenderivater varierer avhengig av substitusjonsgrad, hva er substituentgruppene og deres relative posisjoner. Dermed kan benzen lide ape, di, tri, tetra, etc., Substitusjoner
Når de to gruppene er knyttet til tilstøtende karbonatomer, brukes 'ortho' kirkesamfunnet; Hvis det er et karbon mellom å skille dem, 'mål'; Og hvis karbonatomer er i motsatte posisjoner, 'for'.
I de nedre bildene vises eksempler på benzenderivater med sine respektive navn styrt av IUPAC. De er også ledsaget av vanlige eller tradisjonelle navn.
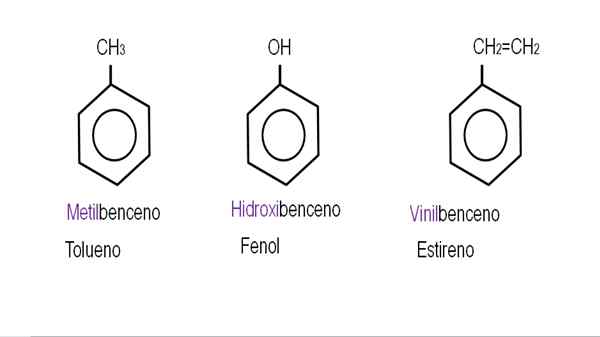 Monoderivert benzen. Kilde: Gabriel Bolívar.
Monoderivert benzen. Kilde: Gabriel Bolívar. 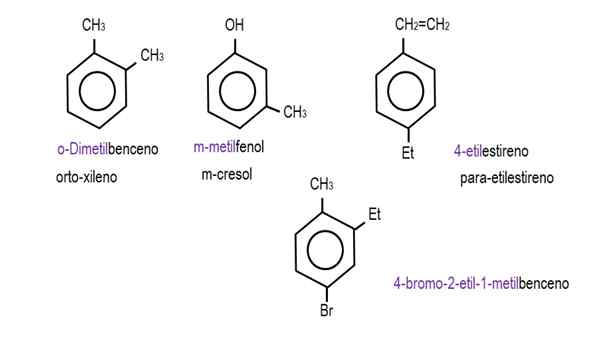 Andre benzenderivater. Kilde: Gabriel Bolívar.
Andre benzenderivater. Kilde: Gabriel Bolívar. Legg merke til at i de trisustuerte benzenene orto -indikatorene, for og målet, slutter de å være nyttige.
Toksisitet
Benzen er en forbindelse som må manipuleres nøye. Gitt dens spesielle lukt, kan de umiddelbare negative effektene være kvelning, svimmelhet, hodepine, skjelvinger, døsighet, kvalme og til og med død (før en høy eksponering). Hvis, i tillegg til det som allerede er nevnt, kan magesmerter og anfall forårsake akutt.
I tillegg er langvarige effekter under konstant eksponering for denne væsken kreftfremkallende; Øker sjansene for at individet lider av en eller annen type kreft, spesielt blod: leukemi.
I blodet kan det redusere konsentrasjonen av røde blodlegemer, forårsake anemi, og også påvirke benmargen og leveren, hvor den blir assimilert av kroppen for å generere enda mer giftige benzenderivater; For eksempel hydroxiquinon. Det samler seg også i nyrene, hjertet, lunger og hjerne.
Referanser
- Morrison, r.T. Og Boyd, r. N. (1987). Organisk kjemi. (5. utgave). Addison-Wesley Iberoamericana.
- Carey, f. TIL. (2008). Organisk kjemi. (6. utgave). McGraw-Hill, Intermerica, redaktører S.TIL.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Nasjonalt senter for bioteknologiinformasjon. (2019). Benzen. PubChem -database. CID = 241, utvunnet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Benzen. Hentet fra: i.Wikipedia.org
- Garcia Nissa. (2019). Hva er benzen? - Bruk, struktur og formel. Studere. Gjenopprettet fra: Studie.com
- Centers for Disease Control and Prevention. (4. april 2018). Fakta om benzen. Gjenopprettet fra: nødsituasjon.CDC.Gov
- Verdens helseorganisasjon. (2010). Eksponering for benzen: En stor folkehelseproblem. [PDF]. Gjenopprettet fra: hvem.int
- Fernández Germán. (s.F.). Benzen -nomenklaturproblemer. Organisk kjemi. Gjenopprettet fra: Chemicicaorganica.org
- « Kosmopolitisme -konsept, opprinnelse, visjon om Kant, samfunnet
- Turistgeografiobjekt av studier, opprinnelse, hjelpevitenskap »

