Berylliumhistorie, struktur, egenskaper, bruker

- 4735
- 34
- Prof. Theodor Gran
Han Beryllium Det er et metallisk element som tilhører gruppe 2 eller IIA i det periodiske bordet. Det er det mest lette alkaliske metallet i gruppen, og er representert av BE -symbolet. Dets atom og kation er også mindre enn deres jevnaldrende (Mg, CA, Mr ...).
På grunn av sin uvanlige belastningstetthet forekommer dette metallet vanligvis ikke isolert. De vet om 30 mineraler som inneholder det, blant dem: Beryl (3Beo · al2ENTEN3· 62· 2H2O), Bertrandita (4beo.2SE2.2H2O), El Chrisoberilo (Beal2ENTEN4), og Fenaquita (være2Ja4).
 Metalliske Beryll -pipitas. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Metalliske Beryll -pipitas. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] La Esmeralda, en edelstein, er en variant av Beryl. Imidlertid er rent beryllium ikke så slående; Det ser blek gråaktig lysstyrke (overlegen bilde), og har blitt oppnådd i form av pepitas eller drager.
Berylliet har et sett med karakteristiske fysiske egenskaper. Den har lav tetthet; høy termisk og elektrisk oppførsel, så vel som dens termiske kapasitet og varmeavledning; Det er ikke et magnetisk metall; og har også en passende kombinasjon av stivhet og elastisitet.
Alle disse egenskapene har ført til at Beryllium er et metall med mange applikasjoner, alt fra bruk i kobberlegeringer for utdyping av verktøy, til bruk i raketter, fly, biler, atomreaktorer, x -lyringsutstyr, resonans kjernefysisk magnetisk osv .
Berylliet har 10 kjente isotoper, alt fra 5Være en 14Være, å være den 9Vær den eneste stallen. Det er også et veldig giftig metall, som spesielt påvirker luftveiene, så det er en begrensning i bruken.
[TOC]
Historien om oppdagelsen din
Berylliet ble oppdaget av Louis-Nicolas Vauguelin i 1798 som et komposisjonelt element i Berilo-mineralet, og et aluminium og berylliumsilikat.
Deretter klarte den tyske kjemikeren Frederic Wöhler, i 1828, å isolere berylliet ved å reagere kalium med berylliumklorid i en platinapot.
Samtidig, og uavhengig, oppnådde den franske kjemikeren Antoine Bussy også isolasjonen av Beryllium. Wöhler var den første som antydet navnet på Beryllium for metall.
Han fikk sitt nåværende navn i 1957, siden han tidligere var kjent som glukinium, på grunn av den søte smaken av noen salter. Men for å unngå forvirring med andre søte smakforbindelser, og med en plante som heter Glucina, ble det besluttet å endre navnet på Beryllium.
Berily struktur
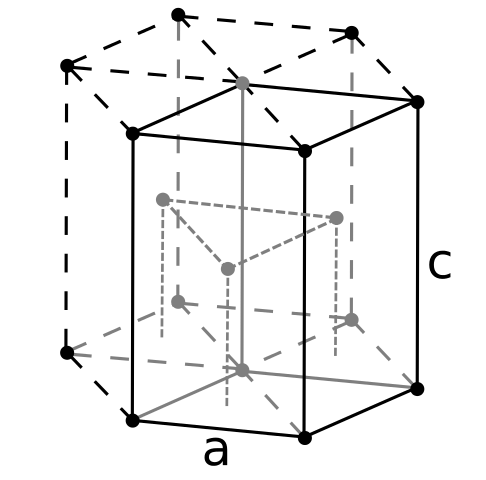 Berily Crign Structure. Kilde: Bruker: Dornelf [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Berily Crign Structure. Kilde: Bruker: Dornelf [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Å være Beryl den letteste av alkalinoterøse metaller, kan det forventes at volumet av atomene vil være det minste av alle. Berylilatomer samhandler med hverandre gjennom den metalliske bindingen, slik at deres "hav av elektroner" og frastøtninger mellom kjernen -modellen den resulterende glassstrukturen.
Det kan tjene deg: Periódinsyre (HIO4): Hva er, struktur, egenskaper, brukDe svarte krystaller av beryllium blir deretter dannet. Disse krystallene har en sekskantet struktur (overlegen bilde), der hver skal ha seks sidevis, og tre andre i topp- og ned fly.
Å være svarte krystaller, det er nyttig. Dette er en av de mest kompakte strukturer som et metall kan ta i bruk; Og det er fornuftig at de så små atomene er "klem" begge for å unngå minst mulig tomhet eller antall hull mellom dem.
Elektronisk konfigurasjon
1s22s2
Det som er lik 4 elektroner, hvorav 2 er fra Valencia. Hvis et elektron til 2p -orbitalen fremmes, vil to SP Hbíbridos orbitaler ha. I berylliumforbindelser kan det således være lineære geometrier, X-Be-x; For eksempel det isolerte BECL -molekylet2, Cl-be-cl.
Egenskaper
Fysisk beskrivelse
Solid grå, lys og sprø farge.
Smeltepunkt
1287 ºC.
Kokepunkt
2471 ºC.
Tetthet
- 1.848 g/cm3 i romtemperatur.
- 1,69 g/cm3 til smeltepunktet (flytende tilstand).
Atomisk radio
232 pm.
Radiokovalent
21.00.
Atomisk volum
5 cm3/mol.
Spesifikk varme
1.824 J/g · mol ved 20 ºC.
Fusjonsvarme
12.21 kJ/mol.
Fordampningsvarme
309 kJ/mol.
Elektronegativitet
1.57 på Pauling -skalaen.
Standard potensial
1,70 v.
Lydhastighet
12.890 m/s.
Termisk ekspansjon
11,3 um/m · k ved 25 ° C.
Termisk ledningsevne
200 w/m · k.
Kjemiske egenskaper
Berylliet er dekket med et lag med beryloksid (beeo) som fungerer som luftbeskyttelse ved romtemperatur. Oksidasjonen av beryllium oppstår ved temperaturer større enn 1000 ºC, med opprinnelse som berylliumoksid og berylliumnitridprodukter.
Det er også motstandsdyktig mot virkning av salpetersyre 15 m. Men det oppløses i saltsyre og alkalier, for eksempel natriumhydroksyd.
applikasjoner
Utarbeidelse av verktøy
Beryllium danner legeringer med kobber, nikkel og alumino. Spesielt legeringen med kobber produserer verktøy med stor hardhet og motstand, og utgjør bare 2% av vekten av legering.
Disse verktøyene produserer ikke gnister når du treffer jernet, noe som gjør dem i stand til bruk i miljøer med høyt innhold av brennbare gasser.
Kan tjene deg: termisk: struktur, egenskaper, formasjon, eksemplerPå grunn av sin lave tetthet har den en lett vekt, som sammen med sin stivhet tillater bruk i romfly, raketter, missiler og fly. Legeringen med beryllium har blitt brukt i utdyping av bildeler. Det har også blitt brukt i Springs utdyping.
På grunn av den store hardheten som Beryllium har gitt dens legeringer, har disse blitt brukt i bremsene til militære fly.
Speil utdyping
Berylliet har blitt brukt i produksjonen av speil på grunn av dens dimensjonale stabilitet og dens evne til å ha en høy rette. Disse speilene brukes i satellitter og brannkontrollsystemer. I tillegg brukes romteleskoper.
I ioniserende stråling
Berylliet er et element med lav tetthet, så det kan anses å være gjennomsiktig for X -Rays. Denne funksjonen tillater bruk i konstruksjonen av vinduene i rørene som produserer x -løp, industriell anvendelse og medisinsk diagnose.
På samme måte brukes beryllium i vinduene til radioaktive emisjonsdetektorer.
I magnetismen som genererer team
Blant egenskapene til Beryllium er ikke et magnetisk element. Dette gjør at den kan brukes i konstruksjonen av artikler av magnetisk resonansutstyr, der magnetiske felt med stor intensitet genereres, noe som minimerer forstyrrelser.
Atomreaktorer
På grunn av det høye fusjonspunktet, har det funnet anvendelse i kjernefysiske reaktorer og keramikk. Beryllium brukes som en kjernefysisk reaksjon moderator og som nøytronprodusent:
9Være + 4Han (α) => 12C +N (nøytron)
Det anslås at for en million berylatomer som er bombet med α -partikler, oppstår opptil 30 millioner nøytroner. Nettopp denne kjernefysiske reaksjonen tillot oppdagelsen av nøytronet.
James Chadwick bombarderte berylliumatomer med α -partikler (HE). Forskeren observerte frigjøring av subátomiske partikler, uten elektrisk ladning, noe som førte til oppdagelsen av nøytroner.
Metallbeskytter
Tilsett en mengde beryllium på overflaten av metaller som kan oksideres, gir en viss beskyttelse. For eksempel reduseres brennbarheten av magnesium og lysstyrken til sølvlegeringer er forlenget.
Hvor befinner det seg?
Berylen finnes i pegmatitten, assosiert med glimmer, feltspat og kvarts. Gjennom bruk av en flotasjonsteknikk er det mulig å skille en blanding av beryl og feltspat. Deretter blir feltspat og beryl konsentrert og utsatt for en behandling med kalsiumhypokloritt.
Det kan tjene deg: forskjeller mellom organiske og uorganiske forbindelserEtterfulgt av en behandling med svovelsyre og kaliumsulfonat, gjennom fortynning oppnås berylflotasjonen, og skiller den fra feltspat.
Berylet behandles med natriumfluorosylikat og brus ved 770 ºC for å danne natriumfluoroberilat, aluminiumoksyd og silisiumdioksid. Deretter blir berylliumhydroksydet av natriumhydroksydhydroksyd fluorroberil løsning utfelt utfelt.
Berylliumfluorid dannes ved å reagere berylhydroksyd med ammoniakalt hydrogenfluorid, og produserer ammonium ammonium. Dette blir oppvarmet for å danne berylliumfluorid, som behandles med varmt magnesium for å isolere beryllium.
Risiko
Beryllium som fint delt metall, i form av løsninger, tørt støv eller røyk, er veldig giftig og kan produsere dermatitt. Imidlertid produseres den største toksisiteten ved innånding.
Opprinnelig kan beryllium indusere overfølsomhet eller allergi, som kan bli belliose eller kronisk sykdom i beryllium (CBD). Dette er en alvorlig sykdom, preget av en reduksjon i lungekapasiteten.
Akutt sykdom er sjelden. Ved kronisk sykdom er det farulomdannelse i hele kroppen, spesielt i lungene. Kronisk belliose forårsaker progressiv dyspné, hoste og generell svakhet (Asthenia).
Akutt belliose kan være dødelig. I Belliosis oppstår det progressive tapet av luftveisfunksjon, siden det er hindring i strømmen av luftveier i luftveiene og redusert oksygenering av blodtrykket.
Referanser
- Royal Society of Chemistry. (2019). Beryllium. Gjenopprettet fra: RSC.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). Beryllium. PubChem -database. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Helmestine, Anne Marie, PH.D. (15. mars 2019). Beryllium -fakta. Gjenopprettet fra: Thoughtco.com
- Wikipedia. (2019). Beryllium. Hentet fra: i.Wikipedia.org
- Lentech b. V. (2019). Beryllium-være. Gjenopprettet fra: Lentech.com
- Selskapsmateriell. (2019). Lær om elementet Beryllium utvunnet fra: Beryllium.com
- D. Michaud. (12. april 2016). Berylliumbehandling og utvinningsproblem. 911 metallurgist. Gjenopprettet fra: 911 Metallurgist.com
- Timothy p. Hanusa. (5. januar 2016). Beryllium. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Les s. Ny mann. (2014). Beryllium sykdom. MSD Manual. Gjenopprettet fra: MSDManuals.com
- « Sportspsykologhistorie, mål og profiler
- Sosial globalisering Sosial dimensjon, fordeler og eksempler »

