Kaliumbiftalatstruktur, nomenklatur, bruk, risiko
- 2227
- 284
- Jonathan Moe
Han Kaliumbiftalat Det er en kjemisk, fast, hvit, løselig forbindelse, som er kommersielt i tilstand med høy renhet. Det brukes som et primært mønster for å standardisere løsninger i syre-base-kvalifikasjoner; Det brukes også som en bufferløsning for å holde pH i løsninger stabil.
Det er en stabil, ikke -hygroskopisk forbindelse, som letter fremstilling av løsning siden den ikke absorberer vann under den tunge prosessen. Det kan fremstilles ved reaksjonen mellom fotalyre og en KOH -løsning, der et hydrogen av ftalinsyremolekylet erstattes av et kaliumatom.
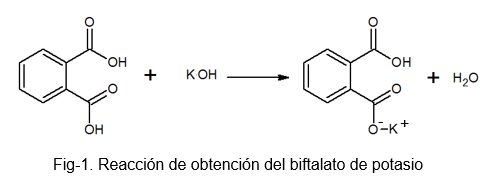
Kaliumbiftalat mottar dette navnet fordi det i molekylet er et litt surt hydrogen. Dette hydrogenet er den som er funnet i -OH -gruppen som ligger rett ved siden av karbonylgruppen, som er en del av karboksylen som ikke reagerer. Denne typen salter er kjent som syresalter, ettersom de ikke er helt nøytrale.
[TOC]
Kjemisk struktur

Formel
C6H4CoohCook = c8H5 Ko4
Nomenklatur
- Kaliumbiftalat.
- Kaliumsyre ftalat.
- Kaliumhydrogenofthalat.
Egenskaper
Tetthet
1.636 g/ml.
Molmasse
204.22 g/mol.
Løselighet
Vann og alkohol.
Smeltepunkt
295 ° C med nedbrytning.
Aspekt
Hvit -til -hvitt faststoff.
Spesifikk vekt
1,64 gr/cm3.
Kaliumbiftalatderivatstudie
Derichrografiske målinger har vist at nedbrytningen av kaliumbiftalat begynner mellom 190 ° C og 200 ° C, og ikke -hygroskopisk preparat kan fremstilles mellom 100 ° C og 150 ° C.
Nedbrytningen fortsetter i tre trinn, hvis hastighet avhenger av hastigheten i temperaturøkningen: Dipbotassiumftalatet dannes først, det phtalic anhydrid og vannet elimineres.
Kan tjene deg: kalsiumklorid (CaCl2)Entalpía -endringer kan også oppnås fra derivatet, dette gir informasjon om tilleggsmekanismen for termisk nedbrytning og endringer i tilstanden til prøven.
Bruk og applikasjoner
Denne forbindelsen brukes i analytisk kjemi i syre-base-titrering eller vurdering som et primært mønster for standardisering i fremstilling av løsninger fra forskjellige forbindelser.
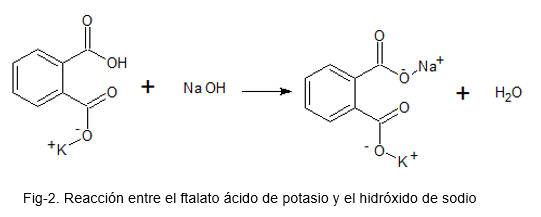
Standardisering av en base (alkali = NaOH)
Ved utarbeidelse av en NaOH -løsning, kan det ikke garanteres at konsentrasjonen som løsningen forblir er riktig; Dette er fordi NaOH er et veldig hygroskopisk fast stoff (absorberer luft fra luften), og for å veie det forblir det med litt fuktighet, noe som gjør mengden stoff ikke den mest optimale.
Når løsningen er utarbeidet, er det nødvendig å vite nøyaktig hvilken konsentrasjon den har gjenstått.
For dette blir en løsning fremstilt med kaliumsyre ftalat, som er et primært mønster (på grunn av dens høye stabilitet); Noen få dråper fenolphthalein acid-base indikator tilsettes og NaOH-løsningen som tittel tilsettes til en rosa farge holdes til stede i kaliumsyren ftalatoppløsning.
Med de oppnådde dataene, blir de relevante beregningene for å finne den virkelige konsentrasjonen av NaOH.
Følgende bilde illustrerer den kjemiske reaksjonen mellom kaliumsyre ftalat og natriumhydroksyd.

Som en bufferløsning i bestemmelsen av pH
En buffer- eller bufferløsning er den som dannes av både syresalt, dette fører til at den forblir i forhold slik at pH -verdien ikke endres når små mengder syre eller base tilsettes.
Kan tjene deg: gravimetri: gravimetrisk analyse, metoder, bruksområder og eksemplerRisiko
- Branneksponering. Som med de fleste organiske faste stoffer, er det mulig at brann ved høye temperaturer eller ved kontakt med en tenningskilde kan oppstå.
- Det fine støvet spredt i luft i tilstrekkelige konsentrasjoner, og i nærvær av en kilde til tenning, er et potensial for farlig støveksplosjon.
- Det er et stabilt stoff ved romtemperatur og under tilstrekkelige lagringsforhold. Overdreven varme og fuktighet bør unngås.
- Det kan være uforenlig med sterke oksidanter som salpetersyre.
- Nedbrytning kan danne karbonoksider som er giftige.
Angående helse
- Ved utilsiktet inntak kan det forårsake oppkast, diaré og irritasjon i membranene på grunn av deres surhet.
- Ved innånding forårsaker det irritasjon i luftveiene og hoste.
- I huden forårsaker det irritasjon.
- I øynene forårsaker det irritasjon, rødhet og smerte.
- Det anses at det ikke er et kreftfremkallende, teratogen eller mutagent stoff.
Nød- og førstehjelp
- Vask øynene med rikelig med vann, fjern bremser i tilfelle å bære dem og la vannet løpe gjennom øynene uten å bli berørt med hendene.
- Hvis det var kontakt med huden, fjern kostymer og fottøy, vask med rikelig med vann og vask plaggene veldig godt før du bruker igjen.
- Ved inntak, unngå å provosere oppkast, drikkevann.
- I tilfelle innånding, ta personen til å puste frisk luft; I tilfelle vanskelig ånde, levere oksygen.
- I alle tilfeller ber om presserende medisinsk assistanse.
- I tilfelle lekkasjer eller søl, samler du produktet i en ren beholder og prøv å gjøre støvet ikke spre.
Det kan tjene deg: Hva er de negative effektene vi har med vannløselighet?Personlig beskyttelsestiltak
- Hold deg utenfor stedet der drinker, mat og fôr lagres (kjæledyrmat).
- Bruk anti -støvmasker, neopren- eller PVC -hansker. For tiden brukes nitrilhansker.
- Bruk tilstrekkelige klær som dekker det meste av kroppen, inkludert dekkede støvler eller sko- og sikkerhetsglass.
- Lokal eksosventilasjon anbefales, med luftavtrekkssystem, under hensyntagen til den dominerende vindretningen.
- Produktet er blandbar i vann, det blir ikke absorbert på bakken, det er ikke bioakumulerbart eller biologisk nedbrytbart, det forventes ikke å påvirke vannlevende liv. På tidspunktet for å forkaste det, må det imidlertid gjøres ved hjelp av spesialisert personell: Ikke kast ved avløp.
- Oppbevares i oransje/grønt område, friskt tørt og ventilert sted, og atskilt fra inkompatibelt materiale.
Referanser
- Merck, (s.f), Merckmillipore.com
- Chang R.,(1992), kjemi, (fjerde utgave), Mexico, McGraw-Hill Inter-American fra Mexico S.A, fra C.V
- Meyer kjemi reagenser, (s.f), Sikkerhetsdatablad, kaliumbiftalat, utvunnet fra, reagentermeyer.com.MX
- Belcher, r.,Erdey, l.,Paulik, f.,Liptay.G.,(Juli 1960), kaliumhydrogenofthateftalatbrann, Scientedirect, Volum 5, utgave 1, Side 53-57, org/10.1016/0039-9140 (60) 80205-6

