Boro -historie, egenskaper, struktur, bruk

- 3499
- 612
- Jonathan Carlsen
Han bor Det er et ikke -metallisk element som leder gruppe 13 i det periodiske tabellen og er representert med det kjemiske symbolet B. Atomnummeret hans er 5, og er det eneste ikke -metalliske elementet i gruppen hans; Selv om noen kjemikalier anser det som en metalloid.
Det blir presentert som et svart brunt pulver, og er i en 10 ppm andel i forhold til jordskorpen. Derfor er det ikke et av de mest tallrike elementene.
 Boro prøve med renhet rundt 99%. Kilde: Alajhasha [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Boro prøve med renhet rundt 99%. Kilde: Alajhasha [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Det er en del av flere mineraler som boraks eller natriumborat, dette er det vanligste bormineralet. Det er også Kurnite, en annen form for natriumborerat; Colemanitt eller kalsiumborat; og ulexitten, natrium og kalsiumborato.
Boratos blir trukket ut i USA, Tibet, Kina og Chile med en verdensproduksjon på omtrent to millioner tonn per år.
Dette elementet har tretten isotoper, og er det mest rikelig elleveB, som utgjør 80,1% av boret, og 10B, som danner de resterende 19,9%.
Bor er et essensielt spor for planter, og griper inn i syntesen av noen viktige planteproteiner og bidrar til vannabsorpsjon. Hos pattedyr virker det nødvendig for beinhelse.
Selv om boret ble oppdaget i 1808 av den engelske kjemikeren Sir Humphry Davy, og den franske kjemikerne Jacques Thérnard og Joseph Gay-Lussac, siden begynnelsen av vår tid i Kina ble brukt boraksen i utdypingen av keramikk av emalje.
Bor og forbindelser har mange bruksområder og anvendelser, alt fra bruk av matbevaring, spesielt margarin og fisk, inntil bruk i behandlingen av kreftsvulster i hjernen, blæren, prostata og andre organer og andre organer og andre organer.
Bor er ikke veldig løselig i vann, men forbindelsene er. Dette kan være en konsentrasjonsmekanisme for bor, samt en kilde til forgiftning med elementet.
[TOC]
Historie
Bakgrunn
Siden eksterne tider har mennesket brukt borforbindelser i forskjellige aktiviteter. El Borax, et mineral kjent som Tincal, ble brukt i Kina i løpet av 300 d år.C. i utdyping av emalje keramikk.
Den persiske alkymisten (865-925) nevnte Boro-forbindelser den første omtale. Rhazes klassifiserte mineralene i seks klasser, hvorav den ene var borokiene som inkluderte bor.
Agricola, rundt 1600, rapporterte om bruk av boraks som en flyt i metallurgi. I 1777 ble tilstedeværelsen av borsyre i en strøm av varme kilder nær Firenze anerkjent.
Oppdagelse av elementet
Humphry Davy, gjennom elektrolyse av en boraksløsning, observerte akkumulering av et svart bunnfall i en av elektrodene. Han varmet også boroksid (B2ENTEN3) Med kalium, og produserte et svart brunt pulver som var den kjente borformen.
Gay-Lussac og Thénard reduserte borsyre ved høye temperaturer i nærvær av jern for å produsere bor. De viste også omvendt prosess, det vil si hvor borsyre er et produkt av boroksidasjon.
Identifisering og isolasjon
Jöns Jakob Berzelius (1827) oppnådde identifisering av Boro som et nytt element. I 1892 klarte den franske kjemikeren Henri Moissan å produsere bor med 98% renhet. Skjønt, det påpekes at bor ble produsert rent av den amerikanske kjemikeren Ezekiel Weintraub, i 1909.
Egenskaper
Fysisk beskrivelse
Krystallinsk fast eller svartbrunt amorft pulver.
Kan tjene deg: peroksider: egenskaper, nomenklatur, bruk, eksemplerMolmasse
10.821 g/mol.
Smeltepunkt
2076 ºC.
Kokepunkt
3927 ºC.
Tetthet
-Væske: 2,08 g/cm3.
-Krystallinsk og amorf ved 20 ºC: 2,34 g/cm3.
Fusjonsvarme
50,2 kJ/mol.
Fordampningsvarme
508 kJ/mol.
Molar kalorikapasitet
elleve.087 J/(mol · k)
Ioniseringsenergi
-Første nivå: 800.6 kJ/mol.
-Andre nivå: 2.427 kJ/mol.
-Tredje nivå: 3.659,7 kJ/mol.
Elektronegativitet
2.04 på Pauling -skalaen.
Atomisk radio
21.00 (empirisk).
Atomisk volum
4,16 cm3/mol.
Termisk ledningsevne
27.4 W/M.K
Elektrisk resistivitet
~ 106 Ω.M (ved 20 ºC).
Høye temperaturer bor er en god elektrisk leder, men ved omgivelsestemperatur blir det nesten en isolator.
Hardhet
~ 9.5 på MOHS -skalaen.
Reaktivitet
Bor påvirkes ikke av saltsyre ved koketemperatur. Imidlertid omdannes den av varm salpetersyre til borsyre (h3Bo3). Boro oppfører seg kjemisk som en ikke -metall.
Reagerer med alle halogener for å gi trihaluros, svært reaktive. Disse har den generelle formelen BX3, Der x representerer halogenet.
Det er kombinert med flere elementer for å stamme boruros. Noen av dem er blant stoffene med større hardhet; For eksempel bor nitrid (BN). Bor er kombinert med oksygen for å danne bortrioksid.
Elektronisk borstruktur og konfigurasjon
Lenker og strukturelle enheter i bor
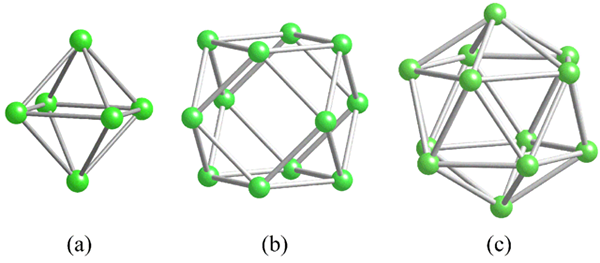 Geometrier av de vanlige strukturelle enhetene for bor. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Geometrier av de vanlige strukturelle enhetene for bor. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Før du adresserer borstrukturer (krystallinsk eller amorf) er det viktig å huske på hvordan atomene deres kan kobles. B-B-lenken er i kovalent essens; Ikke bare det, men fordi naturlig boro -atomer har elektronisk mangel, vil de prøve å levere det i lenkene sine på en eller annen måte.
I boret er det en spesiell type kovalent binding: den av tre sentre og to elektroner, 3C2E. Her deler tre boratomer to elektroner, og definerer en trekant, et av de mange ansiktene som finnes i deres strukturelle polyhedros (overlegen bilde).
Fra venstre mot høyre har vi: Octaedro (A, B6), Cuboctaedro (b, b12), Og isocasedro (c, b12 også). Alle disse enhetene deler en funksjon: de er dårlige i elektroner. Derfor må de koble kovalent seg imellom; Og resultatet er en overraskende lenkefest.
I hver trekant av disse polyhedros er 3C2E -lenken til stede. Ellers kunne det ikke forklares hvor bor, som er i stand til å danne bare tre kovalente bindinger i henhold til Valencia Link Theory, kan ha opptil fem koblinger i disse polyhedrale enhetene.
Borstrukturene består da av en ordning og repetisjon av disse enhetene som ender opp med å definere en krystall (eller et amorf faststoff).
Boro α-Romboédrico
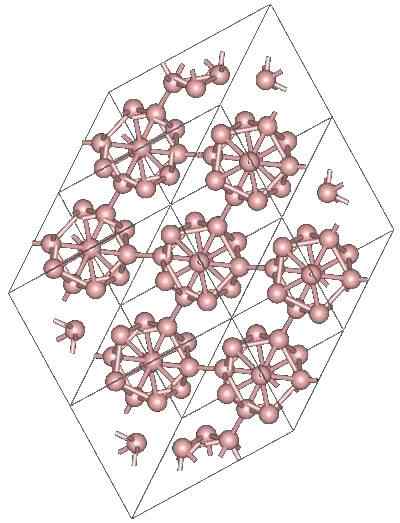 Krystallinsk struktur av α-Romboédrico Boron Alotropic. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Krystallinsk struktur av α-Romboédrico Boron Alotropic. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Det kan være andre polyhedrale enheter av boro, samt en forbindelse bare med to atomer, b2; en bor "linje" som må knyttes til andre atomer etter den høye elektroniske mangelen.
Icosaedro er den desidert foretrukne enheten til boret; Den som føles bedre. I det øvre bildet blir det for eksempel verdsatt hvordan disse B -enhetene12 De fletter sammen for å definere den rhombohedrale krystallen til bor-α.
Hvis en av disse icosaedros ønsket å bli isolert, ville det være en komplisert oppgave, fordi deres elektroniske mangel tvinger dem til å definere en krystall der hver og en gir elektronene som de andre naboene trenger.
Β-Romboédrico bor
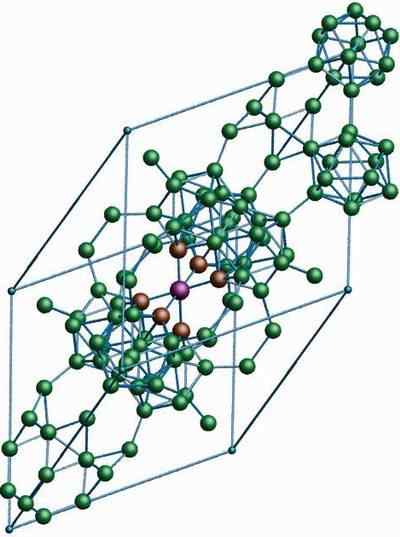 Krystallinsk struktur av β-Romboédrico Boron Alotropic. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Krystallinsk struktur av β-Romboédrico Boron Alotropic. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Β-Romboédrico bor alotropisk, som navnet allerede indikerer, har rhomboédica-krystaller så vel som bor-a; Imidlertid er det forskjellig i sine strukturelle enheter. Det ser ut som et utenomjordisk skip laget med boratomer.
Det kan tjene deg: litiumhydroksid (LIOH)Hvis du nøye kan se icosahedric -enhetene på en diskret og sammenslått måte (i sentrum). Det er også B -enheter10 og ensomme boratomer som fungerer som en bro for de nevnte enhetene. Av alt er dette det mest stabile boret.
Boro-y Gema
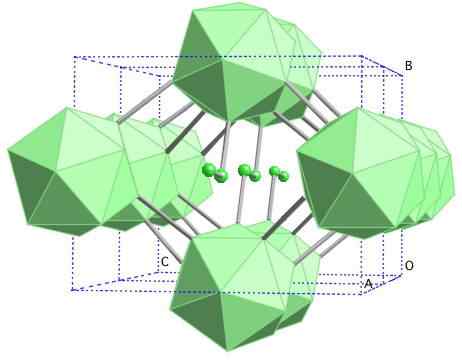 Krystallinsk struktur av bor-y. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Krystallinsk struktur av bor-y. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] I dette bor alotrope er enheter B koordinert2 og b12. B2 presenterer så mye elektronisk mangel som faktisk fjerner elektroner fra B12 Og det er derfor en ionisk karakter i dette faste stoffet. Det vil si, ikke bare er de kovalent forent, men det er typen elektrostatisk attraksjon [B2-] [B12+].
Boro-y krystalliserer i en gema saltstruktur, det samme som for NaCl. Andre alotroper fra bor til høyt trykk (20 GPa) og temperaturer (1800 ° C) oppnås, og forblir deretter stabile under normale forhold. Den faktiske stabiliteten konkurrerer med β-Romboédrico-bor.
Kubikk og amorf
Andre alotroper av boret består av aggregater av B -atomer som om de var forent med en metallbinding, eller som om de var ioniske krystaller; det vil si at det er et kubikkbor.
Også, og ikke minst, er det amorfe bor, hvis disposisjon av B -enheter12 Det er tilfeldig og rotete. Det presenteres som et fint eller glassaktig pulver med mørke farger og ugjennomsiktig brun.
Borofenos
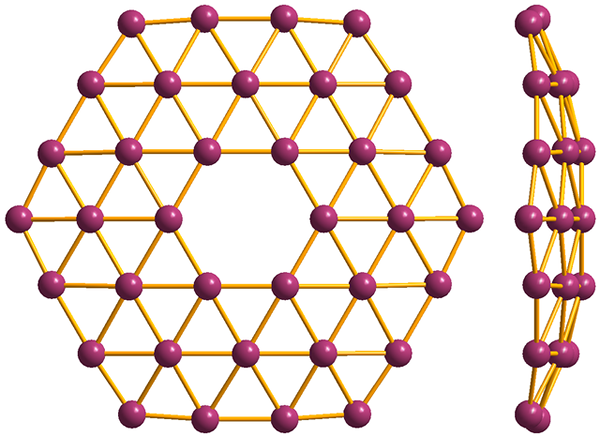 Struktur av den enkleste av borofenos, B36. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Struktur av den enkleste av borofenos, B36. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Og til slutt er den mest nye og bisarre alotropiske av Boro: Borofenos (høyere bilde). Det består av et apelag med boratomer; ekstremt tynn og analog med grafen. Merk at den beholder de berømte trekantene, karakteristisk for den elektroniske mangelen som atomene lider.
I tillegg til borofenos, hvorav b36 Det er det enkleste og små, det er også Boros klynger. Borosferene (bilde nedenfor) består av et sfærisk bur som ligner på en ball med førti atomer i boro, b40; Men i stedet for å ha glatte kanter, er de brå og uregelmessige:
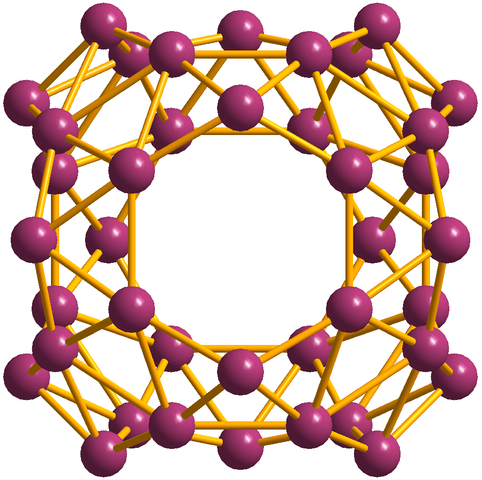 Borosferenos Unit, B40. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Borosferenos Unit, B40. Kilde: Materialsionist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Elektronisk konfigurasjon
Den elektroniske konfigurasjonen av boret er:
[Han] 2s2 2 s1
Derfor tre elektroner fra Valencia. Han mangler fem til for å fullføre sin okteto av Valencia, og han kan knapt danne tre kovalente bånd; Jeg trenger en fjerde dativ lenke for å fullføre oktetten din. Bor kan miste sine tre elektroner for å skaffe seg en oksidasjonstilstand på +3.
Å skaffe
Bor isoleres ved å redusere borsyre med magnesium eller aluminium; Metode som ligner på Gay-Lussac og Thénard. Det har vanskeligheten med borforurensning med Boruros av disse metaller.
En prøve med høy renhet kan oppnås ved en gassformet reduksjon av bortriklorid, eller tribromid, med hydrogen på elektrisk tantrisk oppvarmede filamenter.
Et bor med høy renhet fremstilles ved nedbrytning ved høye Diborano -temperaturer, etterfulgt av rensing ved fusjon av sone- eller czocharalski -prosesser.
applikasjoner
I bransjen
Elementært bor har blitt brukt i herding av stål. I en legering med jernet som inneholder mellom 0,001 og 0,005 % bor. Det brukes også i den ikke -jernholdige industrien, vanligvis som deoksidant.
I tillegg brukes bor som en gjørmete i kobberbaserte legeringer og høykledningskobber. I halvlederindustrien tilsettes små mengder boro som dopingmiddel for silisium og Germanio.
Kan tjene deg: Isopreno: Struktur, egenskaper, applikasjonerBorooksid (B2ENTEN3) er blandet med silika for å lage et varmebestandig glass (borosylikatglass), brukt i kjøkkenutstyr og visse laboratorieutstyr.
Boro karbid (b4C) Det er et ekstremt hardt stoff som brukes som slipende og forsterkningsmiddel i sammensatte materialer. Aluminium Boruro (ALB12) Det brukes som en diamantstøvbytte for frostet og polert.
Boro brukes i legeringer, for eksempel i sjeldne jordmagneter, legering med jern og neodymium. De dannede magnetene brukes i fremstilling av mikrofoner, magnetiske brytere, hodetelefoner og partikkelakseleratorer.
I medisin
Kapasiteten til Boro-10-isotopen (10B) For å fange nøytroner, har det blitt brukt å avgi α -type stråling for behandling av hjernesvulster i en teknikk kjent som Boron Neutron Capture Therapy (BNCT).
Han 10B i form av forbindelser akkumuleres i kreftsvulsten. Deretter blir tumorsonen med nøytroner utstrålt. Disse samhandler med 10B, hva som forårsaker utslipp av α -partikler. Disse partiklene har en høy relativ biologisk effekt, og på grunn av deres store størrelse har de liten rekkevidde.
Så den destruktive virkningen av α -partikler er innesperret i tumorceller, og utfører deres ødeleggelse. BNCT brukes også i behandling av nakke-, lever-, blære- og prostatasvulster.
Biologisk handling
En liten mengde borsyre eller borerat -formet bor er nødvendig for vekst av mange planter. En bormangel manifesteres i deformert vekst av planter; det "brune hjertet" av grønnsaker; og den "tørre råten" av sukkerroer.
Bor kan være nødvendig i små mengder for å opprettholde beinhelsen. Det er studier som indikerer at mangel på bor vil være involvert i leddgiktgenerering. Det ville også gripe inn i hjernefunksjoner som minne og koordinering øye-mann.
Noen eksperter påpeker at 1,5 til 3 mg bor skal inkluderes i det daglige kostholdet.
Risiko og forsiktighet
Bor, boroksid, borsyre og boratos, regnes som ikke -toksisk. LD50 for dyr er 6 g bor/kg kroppsvekt, mens stoffer med en LD50 større enn 2 g/kg kroppsvekt anses som ikke -toksisk.
På den annen side forårsaker forbruket av mer enn 0,5 mg/bor dag i 50 dager mindre fordøyelsesproblemer, noe som tyder på toksisitet. Noen rapporter påpeker at et overskudd i borinntaket kan påvirke magen, leveren, nyrene og hjernen og hjernen.
På samme måte er det indikert kortsiktige irriterende effekter i nasopharynx, øvre luftveier og øynene for eksponering for bor.
Rapportene om giftigheten av bor er knappe, og i mange tilfeller presenteres toksisitet i veldig høye doser, høyere enn den generelle befolkningen er utsatt.
Anbefalingen er å overvåke borinnholdet i mat, spesielt grønnsaker og frukt. Offentlige helsebyråer må overvåke at vannborkonsentrasjon ikke overstiger de tillatte grensene.
Arbeidere som er utsatt for støv som inneholder bor, skal bruke masker som beskytter luftveiene, hansker og spesielle støvler.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Allotroper av bor. Hentet fra: i.Wikipedia.org
- Prof. Robert J. Lancashire. (2014). Foredrag 5b. Struktur av elementene (ikke-metaller, b, c). Department of Chemistry, University of the West Indies, Mona Campus, Kingston 7, Jamaica. Gjenopprettet fra: Chem.Uwimona.Edu.JM
- Manisha Lalloo. (28. januar 2009). Ultra-Pure borstruktur oppdaget. Kjemiverden. Gjenopprettet fra: Chemistryworld.com
- Bell Terence. (16. desember 2018). En profil av metallboret. Gjenopprettet fra: TheBalance.com
- Redaktørene av Enyclopaedia Britannica. (2019). Bor. Gjenopprettet fra: Britannica.com
- Byrå for giftige stoffer og sykdomsregister. (2010). Toxfaqs ™ på Boron. [PDF]. Hentet fra: ATSDR.CDC.Gov
- Helmestine, Anne Marie, PH.D. (6. februar 2019). Bor kjemiske og fysiske egenskaper. Gjenopprettet fra: Thoughtco.com

