Natriumborhydrid (NABH4) -struktur, egenskaper, bruk

- 4433
- 439
- Jonathan Moe
Han natriumbor Det er et uorganisk fast stoff hvis kjemiske formel er NABH4. Det kan betraktes som representativt for alkalisk borhydruros og er den vanligste av disse. Det er et krystallinsk hvitt fast stoff.
Ved kontakt med vann, NABH4 kan generere varme og hydrogen H2 som er drivstoff, så det må håndteres med forsiktighet. For hvor enkelt det kan generere hydridioner h-, Natriumbor er en moderat reduserende forbindelse, så den er mye brukt i kjemiske reaksjoner for dette formålet.
 Natriumborhydrid, NABH4, fast. Ondřej Mangl [Public Domain]. Kilde: Wikimedia Commons.
Natriumborhydrid, NABH4, fast. Ondřej Mangl [Public Domain]. Kilde: Wikimedia Commons. Den reduserende egenskapen brukes også i papirindustrien, siden den gjør det mulig å forbedre egenskapene til lysstyrke og stabilitet av massen og papiret når du virker mot oksidasjon av cellulose, hovedkomponenten i papiret.
Fordi det i nærvær av vann lett kan danne hydrogen, har muligheten for å bruke det som en reversibel hydrogenkilde i brenselceller også blitt undersøkt.
Den har andre bruksområder alle basert på dens reduserende eiendom, for eksempel i legemiddelindustrien.
[TOC]
Struktur
Natriumbor er en ionisk forbindelse. Det er dannet av Borhydride anion [BH4]- sammen med natriumna -kationen+.
Anionen [BH4]- Det er tetraedralt.
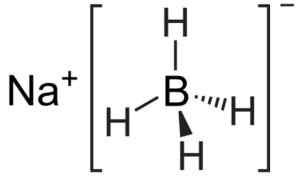 Natriumborhydridstruktur. Kemikungen [Public Domain]. Kilde: Wikimedia Commons.
Natriumborhydridstruktur. Kemikungen [Public Domain]. Kilde: Wikimedia Commons. Lewis -strukturen er som følger:
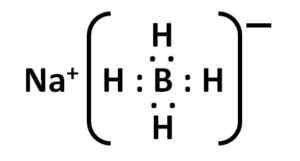 Nabh Lewis elektronisk struktur4. Forfatter: Marilú Stea.
Nabh Lewis elektronisk struktur4. Forfatter: Marilú Stea. Nomenklatur
-Natriumbor
-Natrium tetrahydroate
-Natrium tetrahydrurorat
Fysiske egenskaper
Fysisk tilstand
Krystallinsk hvitt fast stoff.
Molekylær vekt
37,84 g/mol
Selvordemperatur
∼ 220 ºC
Nedbrytningstemperatur
> 250 ºC
Tetthet
1.074 g/cm3 ved 20 ºC
Kan tjene deg: Grignard Reagens: Forberedelse, applikasjoner, eksemplerLøselighet
Nabh4 Det er ganske løselig i vann (55 g/100 ml ved 25 ° C), hvor delvis hydrolyserer. Det er løselig i tetrahydrofurano (THF) og er uoppløselig i Diety Ether.
Kjemiske egenskaper
Natriumbor oppløses i vann, der det lider av en innledende nedbrytning eller hydrolyse som gjør løsningen grunnleggende, noe som forhindrer påfølgende hydrolyse.
[Bh4]- + H2O → B (OH)3 + H2↑ + Åh-
Dette forklares fordi [BH4]- samhandle med h+ Vann, hvor h+ Ta en hydrid H -anion- Å danne h2. Det kan sies at BH3 konkurrerer med h+ For hydrid h-.
I sur medium hydrolyse er fullstendig på grunn av overflod av H -ioner+.
Nabh4 Det er stabilt i tørr luft. Det er ikke ustabilt.
På grunn av hydridioninnholdet er natriumbor en reduserende forbindelse. Det gjør det mulig å redusere karbonylgruppen C = O A C-OH, det vil si karbonylforbindelser til alkoholer.
Nabh4 På egen hånd reduserer den ikke dobbeltbindinger C = C, ikke engang konjugatene med karbonylgrupper -C = C -C (= O)-.
Imidlertid når du kommer i kontakt med protoninsyrer (for eksempel HCl) eller Lewis -syrer (for eksempel BCL3 eller Alcl3) Diborano B dannes2H6. Og hvis denne reaksjonen utføres i nærvær av organiske forbindelser med dobbeltbindinger C = C DiBorano B2H6 Utfører hydrobacion av disse.
I nærvær av passende katalysatorer og spesifikke forhold kan natriumbor redusere forskjellige typer funksjonelle grupper.
Risiko
Varmen fra hydrolysereaksjonen i vann er nok til å slå på hydrogenet som dannes i den. Så det er viktig å være forsiktig når du manipulerer det.
Nabh4 Den er lett på og blir lett brent.
Å skaffe
Den typiske NABH -preparatreaksjonen4 Det er gjennom natriumhydrid nah og b (OCH3)3 Ved en temperatur på omtrent 250 ºC:
Det kan tjene deg: vannelektrolyse4 nah + b (och3)3 → NABH4 + 3 NAOCH3
applikasjoner
I kjemiske reduksjonsreaksjoner
For å være en kilde til hones h-, Nabh4 Det er en reduserende forbindelse og brukes til å fremstille andre kjemiske forbindelser. For å gjøre dette brukes det i apratotiske polare løsningsmidler, det vil si uten H -protoner+, slik som dimetylsulfoksyd, heksametylfosforal og dimetyloformamid.
Det brukes som et reduserende middel i både organiske og uorganiske kjemiske reaksjoner.
Det gjør det mulig å redusere aldehydos til primære alkoholer og ketoner til sekundære alkoholer.
Det reduserer også alkylhalogenider til hydrokarboner som jododan til Dean.
Hvis det fungerer alene, påvirker ikke reduksjonen andre funksjonelle grupper som ester, karboksylsyre, nitril og sulfon.
Eiendommen til ikke å redusere dobbeltbindinger C = C, ikke engang konjugatene med karbonylgrupper -C = C-C (= O)-, lar deg tilberede umettede alkoholer -C = C-CH2-Åh.
For å redusere aromatiske forbindelser krever nitrados til deres tilsvarende aniliner tilstedeværelse av katalysatorer som koboltklorid eller tinn. Reduser disulfider til Thioles.
I nærvær av passende forhold og katalysatorer tillater det å redusere karboksylsyrer, estere, midler, nitrils, imin, epoksider og til og med doble og trippelbindinger.
I h2 I brenselceller
Nabh4 Det kan gjøres om til en brenselcelle.
Nabh4 I nærvær av en alkalisk løsning av KOH eller NaOH er den hydrolysert og produserer hydrogen H2 som kan brukes som drivstoff i et polymert elektrolyttdrivstoffbatteri.
Det er også undersøkt som H -materiale for H -lagring av H2 reversibelt.
NABH -nanopartikler syntetiseres4 og stabilisere med et overflateaktivt middel. Etter en behandling med NICL2 Et beskyttende lag eller belegg dannes som regulerer frigjøring av h2 helt reversibelt.
Det kan tjene deg: Sølvnitrat (AGNO3): Struktur, egenskaper, bruksområder, toksisitetDette nye nanometriske materialet vil tillate bruk av H2 som produsert rent og fornybart drivstoff.
 Kjøretøy som fungerer med hydrogenbrenselcelle. Dr. Artur Braun (Arturbraun) [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Kjøretøy som fungerer med hydrogenbrenselcelle. Dr. Artur Braun (Arturbraun) [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. I masse- og papirindustrien
Natriumbor brukes til å forbedre lysstyrken og andre fysiske egenskaper ved masse og papir.
Nedbrytningen av cellulosematrisen til papiret skjer gjennom komplekse prosesser som involverer oksidasjon. Hydroksylgrupper oksiderer karbonyl og karboksyl, dette fører til misfarging av papir og reduserte fysiske egenskaper.
Når du behandler massen eller papiret med NABH4, Dette reduserer aldehydos og ketoner til grupper -OH uten å påvirke syrekarboksylgrupper, forbedre stabiliteten og lysstyrken til verdier større enn initialene.
 Nabh4 gjør det mulig å forbedre papirets lysstyrke. Forfatter: Rawpixel. Kilde: Pixabay.
Nabh4 gjør det mulig å forbedre papirets lysstyrke. Forfatter: Rawpixel. Kilde: Pixabay. I flere bruksområder
Natriumbor brukes til å behandle avløpsvann, som et smaksmaskinsmiddel i mat- og drikkeindustrien, som et beleggsmiddel og for behandling av overflater, i produksjonen av tobakk, i farmasøytisk, tekstil og tekstilindustriskinn.
Referanser
- Christian, m.L. og aguey-zinsou, k.-F. (2012). Kjerne-skallstrategi som fører til høy reversibel hydrogenlagringskapasitet for NABH4. ACS Nano 2012, 6, 9, 7739-7751. Gjenopprettet fra puber.ACS.org.
- Nora de Souza, m.V. og Alves v., T.R. (2006). Nyere metodologier mediert av natriumborhydrid i reduksjon av forskjellige klasser av forbindelser. App. Organometal. Chem. 2006; 20: 798-810. Hentet fra online bibliotek.Wiley.com.
- Imamoto, t. (1991). Reduksjon. Natriumborhydrid. I å forstå organisk syntese. Gjenopprettet fra Scientedirect.com.
- Tang, l.C. (1986) Stabilisering av papir gjennom natriumborhydridbehandling. I historiske tekstil- og papirmaterialer. Kapittel 24. Side 427-441. Fremskritt innen kjemi, bind 212. Gjenopprettet fra puber.ACS.org.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Morrison, Robert Thornton; og Boyd, Robert Neilson. 1992. Organisk kjemi. Prentice-Hall. ISBN 81-203-0765-8.
- ELLER.S. National Library of Medicine. (2019). Natriumborhydrid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov.

