Litiumbromidstruktur, egenskaper, bruksområder
- 748
- 171
- Prof. Oskar Aas
Han Litiumbromid Det er et nøytralt salt av et alkalisk metall hvis kjemiske formel er libr. Formelen uttrykker at dets krystallinske faststoff er sammensatt av li -ioner+ og Br- I et forhold på 1: 1. Krystallene dine er hvite eller lette beige. Det er veldig løselig i vannet, og det er også et ganske hygroskopisk salt.
Denne siste egenskapen tillater bruken som et tørkemiddel i klimaanlegg og kjølesystemer. På samme måte ble litiumbromid brukt siden begynnelsen av 1900 -tallet i behandlingen av visse psykiske helseforstyrrelser, og forlot bruken på grunn av upassende bruk av salt.
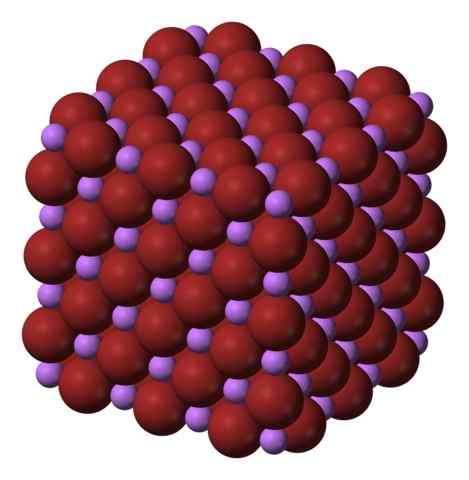
 Kubikk krystallinsk struktur på libren. Kilde: Benjah-BMM27 via Wikipedia.
Kubikk krystallinsk struktur på libren. Kilde: Benjah-BMM27 via Wikipedia. Libren er produsert ved behandling av litiumkarbonat, Li2Co3, med bromhytinsyre. Etter oppvarming av mediet, presipiterer i den vandige oppløsningen som hydrat.
Dette saltet irriterer huden og øynene ved kontakt, mens du produserer irritasjon av luftveissekanaler ved innånding. Inntaket av litiumsalter kan forårsake kvalme, oppkast, diaré og svimmelhet.
[TOC]
Litiumbromidstruktur
Libr -formelen gjør det klart at andelen Li/BR er lik 1; For hver kation li+ Det må være en br anion- av motstykke. Derfor må denne andelen holdes konstant i hvert hjørne av Libr -krystallen.
Ionene li+ og Br- De tiltrekker hverandre, reduserer frastøttene mellom like belastninger, for å forårsake en kubikk krystalltype perle; Dette er isomorf til NaCl (overlegen bilde). Merk at hele settet har en kubisk geometri.
I denne krystallen, li+ De er mindre og har en lett fiolett farge; Mens Br- De er mer klumpete og en intens brun farge. Det observeres at hvert ion har seks naboer, som er det samme som å si at de presenterer en oktaedrisk koordinering: libr6 eller li6Br; Imidlertid, hvis den enhetlige cellen blir vurdert, forblir andelen Li/BR 1.
Kan tjene deg: krystallinsk strukturDette er den krystallinske strukturen som helst som er vedtatt av libren. Imidlertid kan det også danne andre typer krystaller: wurzita, hvis krystalliserer ved lave temperaturer (-50 ° C) på et underlag; O kubikk sentrert på kroppen, eller CSCL -type, hvis kubikkglasssaltet blir utsatt under høyt trykk.
Hydrater og glass
Ovennevnte er aktuelt for libren vannfri. Dette saltet er hygroskopisk, og kan derfor absorbere fuktigheten i miljøet, og ispedd vannmolekyler til sine egne krystaller. Dermed oppstår libr · NH hydrater2Eller (n = 1, 2, 3 ..., 10). For hvert hydrat er den krystallinske strukturen forskjellig.
For eksempel bestemte krystallografiske studier at libren · h2Eller adoptere en Perovskita -typestruktur.
Når disse hydratene er i vandig oppløsning, kan de strømme over og vekkes seg selv; Det vil si at de tar i bruk en krystallinsk, men molekylært uordnet struktur. Under slike forhold blir vannhydrogenbroer ganske viktig.
Egenskaper
Molekylær vekt
88.845 g/mol.
Utseende
Hvit krystallinsk fast eller lys beige.
Lukt
Toalett.
Smeltepunkt
552 ºC (1.026 ºF, 825 K).
Kokepunkt
1.256 ºC (2.309 ºF, 1.538 K).
Vannløselighet
166,7 g/100 ml ved 20 ° C. Legg merke til din høye løselighet.
Løselighet i organiske løsningsmidler
Løselig i metanol, etanol, eter og aceton. Litt løselig i pyridin, aromatisk forbindelse og mindre polar enn de forrige.
Refraction Index (ηd)
1.784.
Kalorikapasitet
51,88 J/mol · K.
Standard molar entropi (Sθ 298)
66,9 J/mol · K.
tenningspunkt
1.265 ºC. Regnes som ikke -brennbar.
Stabilitet
Stabil. Anhydraformen er imidlertid ekstremt hygroskopisk.
Nedbrytning
Når det dekomponerer ved oppvarming, forårsaker det litiumoksid.
Kan tjene deg: klorogensyrePh
Mellom pH 6 og 7 i vandig løsning (100 g/l, 20 ºC).
Reaktivitet
Litiumbromid er ikke reaktiv under normale miljøforhold. Du kan imidlertid oppleve intense reaksjoner med sterke syrer når temperaturen øker.
Når du oppløses i vann, er det en økning i temperaturen, forårsaket av en negativ entalpi av hydrering.
Produksjon
Libr. oppstår ved å reagere litiumhydroksyd eller litiumkarbonat med bromhyternesyre i en nøytraliseringsreaksjon:
Li2Co3 + HBR => Libr +CO2 + H2ENTEN
Litiumbromid oppnås som hydrat. For å oppnå vannfri form, er det nødvendig å varme opp det hydratiserte saltet under vakuum.
Nomenklatur
Navnet 'litiumbromid' stammer fra å være et metallisk halogenid, oppkalt i henhold til aksje nomenklaturen. Andre navn, like gyldige, men mindre brukt, er litiummonobromure, i henhold til den systematiske nomenklaturen; og det litiske bromidet (den unike valensen til +1 for litium), i henhold til den tradisjonelle nomenklaturen.
applikasjoner
Tørkemiddel
Libren er et hygroskopisk salt, og danner en konsentrert saltlake som er i stand til å absorbere luftfuktighet i et bredt temperaturområde. Denne saltlaken brukes som et tørkemiddel i klimaanlegg og kjølesystemer.
Fibre
Det brukes til å øke volumet av ull, hår og andre organiske fibre.
Farmasøytiske addukter
Libre danner addukter med noen farmasøytiske forbindelser, og modulerer virkningen. En addukt er kombinasjonen ved å koordinere to eller flere molekyler, uten en strukturell endring av noen av de forente molekylene.
Beroligende middel
Litiumbromid ble brukt i begynnelsen som beroligende middel i visse psykiske lidelser, slutte å bruke i 1940. For øyeblikket brukes litiumkarbonat; Men i alle fall er litium elementet som utøver den terapeutiske virkningen i begge forbindelser.
Det kan tjene deg: Plumbose Oxide (PBO): Formel, egenskaper, risikoer og brukLitium brukes i behandlingen av bipolar lidelse, etter å ha vært nyttig i kontrollen av maniske episoder av lidelsen. Litium antas å hemme aktiviteten til eksitatoriske nevrotransmittere, for eksempel dopamin og glutaminsyre.
På den annen side øker aktiviteten til det hemmende systemet formidlet av nevrotransmitteren gamma-amino-butikkersyre (GABA) (GABA). Disse handlingene kan være en del av grunnlaget for litiums terapeutiske handling.
Risiko
Kontakt toksisitet
Kutan irritasjon og sensibilisering, allergier. Alvorlige øyeskader eller irritasjon av øynene, på luftveiene, neseborene og halsen.
Inntak
De viktigste symptomene på grunn av litiumbromidinntak er: gastrointestinale lidelser, oppkast og kvalme. Andre bivirkninger på saltinntak inkluderer uro, spasmer og bevissthetstap.
Tilstanden kjent som "bromisme" kan oppstå med litium -bromiddose større enn 225 mg/dag.
I bromismen kan noen av følgende symptomer og tegn oppstå: forverring av kviser og tap av matlyst, skjelvinger, taleproblemer, apati, svakhet og maniacal agitasjon.
Referanser
- Kjemisk formulering. (2019). Litiumbromid. Gjenopprettet fra: Quimica -formulering.com
- David c. Johnson. (10. juli 2008). Ny ordre for litiumbromid. Natur. gjør jeg.org/10.1038/454174A
- Aayushi Jain & r.C. Dixit. (s.F.). Strukturell faseovergang i litiumbromid: Effekt av trykk og temperatur. [PDF]. Gjenopprettet fra: NCPCM.i
- Takamuku et al. (1997). Røntgens difffraksjonsstudier på superkjølt vandig litiumbromid og litiumjodidløsninger. Department of Chemistry, Fakultet for vitenskap, Fukuoka University, Nanakuma, Jonan-Ku, Fukuoka 814-80, Japan.
- Nasjonalt senter for bioteknologiinformasjon. (2019). Litiumbromid. PubChem -database, CID = 82050. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Litiumbromid. Hentet fra: i.Wikipedia.org
- Royal Society of Chemistry. (2019). Litiumbromid. Chemspider. Gjenopprettet fra: Chemspider.com
- « Alkyl Halogenuros egenskaper, innhenting, eksempler
- Mexico i 1700 -tallets handlinger og sosioøkonomiske endringer »

