Alkyl Halogenuros egenskaper, innhenting, eksempler
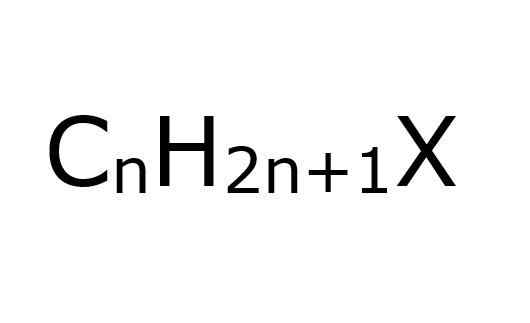
- 2951
- 233
- Theodor Anders Hopland
De Alkyl Halogenuros De er organiske forbindelser der et karbonatom med SP -hybridisering3 Et halogen er koblet kovalent (F, CL, BR, I). Fra et annet perspektiv er det praktisk, å forenkle, anta at de er haloalcanos; Disse er, for de som har blitt erstattet noen H -halogenatomer.
Som navnet tilsier, må halogenatomer knyttes til alquiliske grupper, R, for å bli vurdert av denne typen halogenid; Selv om de strukturelt kan erstattes eller forgrenes og har aromatiske ringer, og fortsatt fortsetter å være et alkylhalogenid.
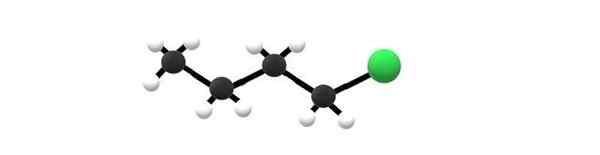 1-klorobutano molekyl, et eksempel på et alkylhalogenid. Kilde: Gabriel Bolívar.
1-klorobutano molekyl, et eksempel på et alkylhalogenid. Kilde: Gabriel Bolívar. Over har du 1-klorobutano-molekylet, som tilsvarer et av de enkleste alkylhalogenidene. Det kan sees at alle karbonene deres har enkle bindinger, og også har SP -hybridisering3. Derfor er den grønne sfæren, tilsvarende atomet av CL, knyttet til et skjelett avledet fra butanalkanen.
Eksempler enda enklere enn 1-klorobutano er de som er avledet fra metangass: den minste hydrokarbon av alle.
Fra CHO -molekylet4 Du kan erstatte H -atomer med, for å si, jod. Hvis en H erstattes, vil CH være3I (yodometan eller metyljodid). Når to H byttes ut, vil CH være2Yo2 (Diyodometan eller metylenjodid). Fulgt og til slutt erstatter jeg alle h gir chi3 (jodform), og ci4 (Carbon Tetrayoduro).
Leie halogenuros er preget av å være veldig reaktive, og med de mest elektronegative atomer i det periodiske tabellen, er det intuitert at gjennom mekanismer symfiner utøver en innflytelse på biologiske matriser.
[TOC]
Egenskaper til alkylhalogenuros
Egenskapene til denne familien av forbindelser avhenger av dens molekylære strukturer. Imidlertid, sammenlignet med de av deres alkaner, er bemerkelsesverdige forskjeller forårsaket av det enkle faktum at det er C-X-koblinger (x = halogenatom).
Det vil si at C-X-koblinger er ansvarlige for enhver forskjell eller likhet mellom en eller flere alkylhalogenuros.
Til å begynne med er C-H-koblinger nesten apolare, gitt den lave elektronegativitetsforskjellen mellom C og H; I stedet har C-X-koblinger et permanent dipolmoment, fordi halogener er mer elektronegativt enn karbon (spesielt fluor).
På den annen side er noen halogener lette (F og CL), mens andre er tunge (BR og i). Dets atommasser former også forskjeller innen C-X-koblinger; Og på sin side, direkte i egenskapene til halogenid.
Derfor er å legge halogener til et hydrokarbon lik å øke dens polaritet og molekylmasse; Det er det samme å gjøre det mindre ustabilt (til en viss grad), mindre brannfarlig og øke koke- eller fusjonspunktene.
Kokende og fusjonspunkter
Ovennevnte er vist, i økende rekkefølge, størrelsen og derfor vekten på de forskjellige halogenene:
F < Cl < Br < I
Deretter forventes det at alkylhalogenider som inneholder F -atomer er lettere enn de som har atomer av BR eller I.
For eksempel blir noen halogenuros avledet fra metan vurdert:
Ch3F < CH3Cl < CH3Br < CH3Yo
Ch2F2 < CH2Cl2 < CH2Br2 < CH2Yo2
Og så videre for det andre derivatproduktet av høyere halogenasjonsgrad. Merk at ordren opprettholdes: Fluor Halogenuros er lettere enn jod. Ikke bare det, men også dens kokende og fusjonspunkter overholder også denne ordren; RF koker ved lavere temperaturer enn RI (R = Cho3, for denne saken).
Kan tjene deg: aromatisk elektrofil substitusjon: mekanisme og eksemplerPå samme måte er alle disse væskene fargeløse, siden elektronene i sine C-X-bindinger ikke kan absorbere eller frigjøre fotoner for å reise annet energinivå. Imidlertid, når de blir tyngre, kan de krystallisere og utvise farger (som jodform gjør, chi3).
Polaritet
C-X-koblinger skiller seg fra polaritet, men i motsatt rekkefølge over:
C-f> c-cl> c-br> c-i
Derfor er C-F-koblinger mer polare enn C-I-lenker. Å være mer polar, RF halogenuros har en tendens til å samhandle gjennom dipol-dipolo-krefter. I mellomtiden, i RBR- eller RI -halogenuros, er dipolmomentene deres svakere og interaksjonene som styres av London -spredningskrefter får større styrke.
Løsemiddelkraft
Ettersom alkylhalogenider er mer polare enn alkanene de stammer fra, øker de evnen til å oppløse et større antall organiske forbindelser. Det er av denne grunn at de har en tendens til å være bedre løsningsmidler; Skjønt, det betyr ikke at de kan erstatte alkanene i alle applikasjoner.
Det er tekniske, økonomiske, økologiske og ytelseskriterier for å foretrekke et halogenert løsningsmiddel fremfor en alkan.
Nomenklatur
Det er to måter å navngi et alkylhalogenid på: ved det vanlige navnet, eller med dets systematiske navn (IUPAC). Vanlige navn er vanligvis mer behagelige å bruke når RX er enkel:
CHCL3
Kloroform: Vanlig navn
Metyl- eller triklormetan -triklorid: iupac navn.
Men de systematiske navnene er å foretrekke (og det eneste alternativet), når de har forgrenede strukturer. Ironisk nok er vanlige navn nyttige igjen når strukturer er for kompliserte (for eksempel de som vil bli sett i den siste delen).
Reglene for å navngi en forbindelse i henhold til IUPAC -systemet er de samme som for alkoholer: hovedkjeden er identifisert, som er den lengste eller den mest forgrenede. Deretter blir karbonatomer oppført fra slutten nærmest substituenter eller forgreninger, og navngir alfabetisk rekkefølge.
Eksempel
For å illustrere det har du følgende eksempel:
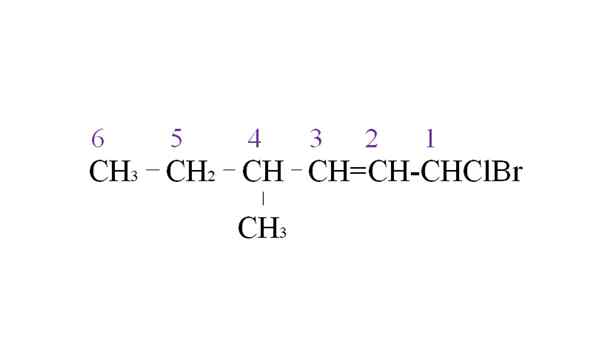 Leie halogenid som et eksempel på nomenklatur. Kilde: Gabriel Bolívar.
Leie halogenid som et eksempel på nomenklatur. Kilde: Gabriel Bolívar. Den første grenen er metylgruppen i C-4; Men å ha en dobbeltbinding denne tidligere prioriteten fremfor regelen som er gitt beskjed. Av den grunn begynner den lengste kjeden å bli oppført fra høyre, ledet av et karbonatom knyttet til to halogener: CL og BR.
Med oppregningen er substituentene navngitt i alfabetisk rekkefølge:
1-Bromo-1-clor-4-metyl-2-heksen.
Å skaffe
For å oppnå alkylhalogenider, må molekyler sendes til en halogeneringsprosess; det vil si å inkorporere halogenatomer i strukturene sine, spesielt til et atom til et SP et karbon3.
Det er to metoder for å oppnå eller syntetisere dem: ved ultrafiolett stråling gjennom en fri radikal mekanisme, eller ved å tilsette hydracest eller halogener.
Halogenering med lys eller ultrafiolett stråling
Den første, den minst passende og med det verste av utbytte, består i bestrålende alkaner med ultrafiolett stråling (Hv) I nærvær av et halogen. For eksempel vises ligningene for klorering av metan:
Ch4 + Cl2 => Ch3Cl + HCl (under ultrafiolett lys)
Ch3Cl + Cl2 => Ch2Cl2 + HCl
Ch2Cl2 + Cl2 => Chcl3 + HCl
CHCL3 + Cl2 => CCL4 + HCl
De fire forbindelsene (CH3Cl, kap2Cl2, CHCL3 og CCL4) De er dannet, og derfor er det en blanding, som kan utsettes for brøkdestillasjon. Imidlertid er denne metoden ikke veldig praktisk, og den foretrekkes å ty til organisk syntese.
Kan tjene deg: fenyleddiksyre: struktur, egenskaper, bruksområder, effekterEt annet eksempel er n-heksanbromasjonen:
Ch3Ch2Ch2Ch2Ch2Ch3 + Br2 => Ch3(BR) Chch2Ch2Ch2Ch3 + HBR
Igjen, i denne reaksjonen brukes lyset eller ultrafiolett stråling for å favorisere dannelsen av frie radikaler. Bromen, som en intens rød væske, blir misfarget når den reagerer, og observerer dermed en rød til fargerik fargeendring når 2-bromheksanen.
Tilsetning av hydracests eller halogener til alkener
Den andre metoden for å oppnå alkylhalogenuros er å behandle alkoholer (ROH) eller alkener (r2C = Cr2) Med hydrace. Hydracides har en Hx generell formel (HF, HCL, HBR og HI). Et eksempel vil bli vist ved bruk av etanol for hver av dem:
Ch3Ch2OH + HF => CH3Ch2F + h2ENTEN
Ch3Ch2OH + HCl => CH3Ch2Cl + H2ENTEN
Ch3Ch2OH + HBR => CH3Ch2Br + h2ENTEN
Ch3Ch2Oh + hei => cho3Ch2I + h2ENTEN
Alkenes kan også legge Hx -molekyler til dobbeltbindinger, og danne sekundære alkylhalogenuros.
Ch2= Ch-ch3 + HBR => Brch2-Ch2-Ch3 + Ch3-Chbr-ch3
BRCH -produktet2-Ch2-Ch3 Det er 1-bromopropano, og cho3-Chbr-ch3 2-bromopropan. Det andre er flertallsproduktet fordi det er det med størst stabilitet, mens førstnevnte er produsert i mindre grad fordi den er mer ustabil. Dette er fordi Cho3Chbrch3 Det er et sekundært alkylhalogenid.
Veldig likt skjer når det som blir lagt til alken er et X -molekyl2:
Ch2= Ch-ch3 + Br2 => Brch2-Chbr-ch3
Imidlertid oppnås et alkylhalogenid med to bromatomer knyttet til tilstøtende karbonatomer; Alkylhalogenid i nabolaget. Hvis de to bomosene som er knyttet til det samme karbonet ble tatt, ville det være et geminal alkylhalogenid, som følgende:
Br2Ch-ch2-Ch3
Reaksjoner
Nukleofil substitusjon
Reaktivitetene til alkylhalogenider er i skjørheten eller motstanden til C-X-koblingen. Jo tyngre halogen, jo svakere vil båndet være, og derfor vil det bryte lettere. I en kjemisk reaksjon er koblinger ødelagt og nye dannes; C-X-koblinger er ødelagt, for å danne en C-G-kobling (G = ny gruppe).
I mer passende vilkår fungerer X som en utgående gruppe, og G som en innkommende gruppe i en reaksjon av Nukleofil substitusjon. Hvorfor skjer denne reaksjonen? Fordi x, som er mer elektronegativ enn karbon, "stjeler" elektronisk tetthet og etterlater et elektronunderskudd som oversettes som en positiv delvis belastning:
CΔ+-XΔ-
Hvis en negativ art er i nærheten (: g-) eller nøytral med et par elektroner tilgjengelig (: g), i stand til å danne en mer stabil C-G-lenke, vil X ende opp med å bli erstattet av G. Ovennevnte kan være representert med følgende kjemiske ligning:
RX +: G- => Rg + x-
Jo svakere C-X- eller R-X-lenken, jo større er dens reaktivitet eller tendens til å erstattes av Nukleofilt middel (eller nukleofil) g; det vil si elskere av kjerner eller positive ladninger.
Eksempler
En serie generelle ligninger for nukleofile substitusjoner som kan lide alkylhalogenider er vist nedenfor:
Rx + oh- => ROH + x- (Alkoholer)
+ Eller'- => Ror' (Ethers, syntese av Williamson)
+ Yo- => RI (Alkyl Yoduros)
+ CN- => RCN (Nitrilos)
+ R'coo- => Rcoor '(estere)
+ NH3 => Rnh2 (Aminer)
+ P (c6H5)3 => RP (C6H5)3+ X- (Fosfoniumsalter)
+ Sh- => Rsh (tioler)
Kan tjene deg: KjemistadierFra disse eksemplene kan de verdifulle alkylhalogenider for organisk syntese mistenkes. En av mange erstatninger som manglet er Friedel Crafts reaksjon, vant til å "leie" aromatiske ringer:
Rx + arh + alcl3 => RRA
I denne reaksjonen erstattes en H av den aromatiske ringen av en gruppe R -fra Rx.
Eliminering
Leie halogenider kan frigjøre Hx -molekyler gjennom en eliminasjonsreaksjon; Spesielt en dehydrohalogenasjon:
R2CH-CXR2 + Åh- => R2C = Cr2 + Hx
Det sies at en dehydrohalogenering oppstår fordi både en H og en X går tapt i samme Hx -molekyl.
Grignard reagenssyntese
Leie halogenider kan reagere med visse metaller som danner Grignards reagens, brukt til å legge R -grupper til andre molekyler. Den generelle ligningen for syntesen er som følger:
Rx + mg => rmgx
Eksempler
Gjennom seksjonene har flere eksempler på alkylhalogenuros allerede blitt nevnt. Noen andre, enkle, er:
-Etylklorid, CH3Ch2Cl
-Isopropil fluoruro, (ch3)2Ch2F
-2-metyl-3-kloropentano, kap3-Ch (Ch3) -CHCL -CH2Ch3
-Secbutilo Yoduro, CH3Ch2Ch2I-ch3
-3-Bromo-6-iodheptano, kap3-Ch2-Chbr-ch2-Ch2-Ch2Yo
-3.4-Dibromo-1-Penteno, Ch3-CHBR-CHBR-CH = CH2
applikasjoner
Løsemiddel
I tidligere seksjoner ble det gjort omtale av løsningsmiddelkapasiteten til alkylhalogenider. Fra denne eiendommen har industrien utnyttet dem som rengjøringsmidler, enten for tekstilstoff, elektroniske komponenter eller fjerne lakkflekker.
De brukes også som løsningsmidler av malerier, eller organiske eller fete prøver for utallige typer analytiske tester.
Organisk syntese
Leie halogenuros er veldig nyttige for å "leie" aromatiske ringer, mens du tjener som en startkilde for syntese av praktisk talt alle andre familier av organiske forbindelser. Syntetisk regnes Rx som en kilde til grupper eller R -kjeder, som kan ønskes å innlemme svært aromatiske forbindelser.
Legemiddelindustrien
Det ble nevnt i begynnelsen at halogenatomer samhandler med biologiske matriser, så i våre organismer kan de ikke gå upåaktet hen uten å generere en endring, positiv eller negativ. Hvis et medikament utøver en positiv effekt på kroppen, kan det å ha et halogenatom som effekten ikke øke.
Så hvis X er direkte koblet til et karbon med SP -hybridisering3, Det vil være et alkylhalogenid og ikke et halogenert derivat. Noen av slike halogenuros er vist nedenfor i følgende bilder av bilder:
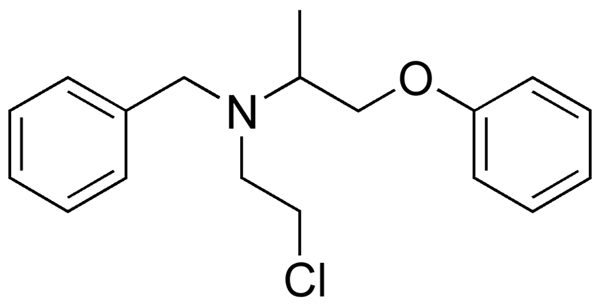 Fenoksibenzamin, et medisin som brukes til å kombinere blodtrykk hos pasienter med feokromocytom. Kilde: Utennt: Mark Pea [Public Domain].
Fenoksibenzamin, et medisin som brukes til å kombinere blodtrykk hos pasienter med feokromocytom. Kilde: Utennt: Mark Pea [Public Domain].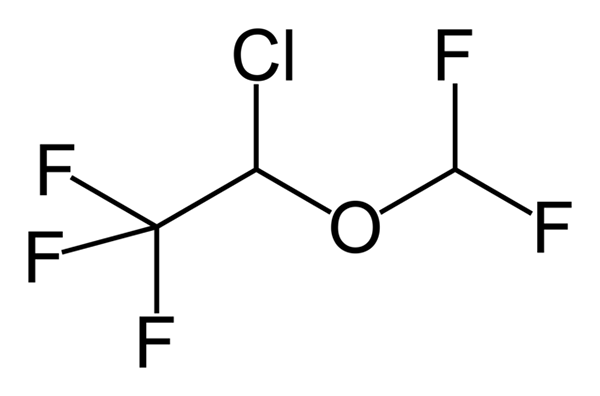 Isoflurano, en inhalasjonsbedøvelse. Kilde: Benjah-BMM27 [Public Domain].
Isoflurano, en inhalasjonsbedøvelse. Kilde: Benjah-BMM27 [Public Domain].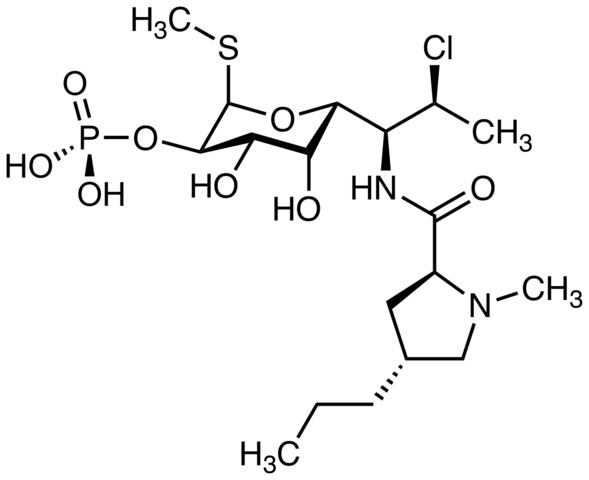 Clindamycin, et antibiotika. Kilde: M Mitcheltrate [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)].
Clindamycin, et antibiotika. Kilde: M Mitcheltrate [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)].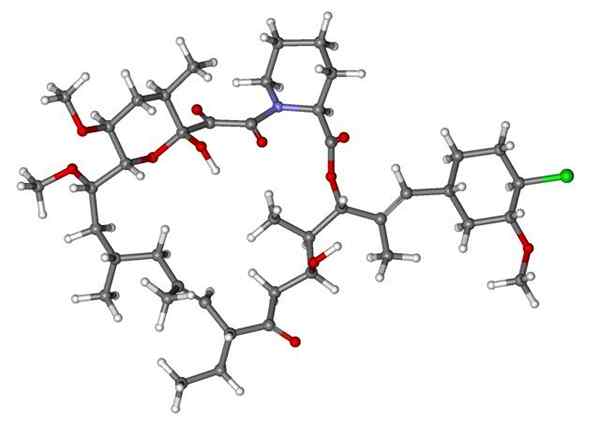 Pimecrolimus, pleide å behandle atopisk dermatitt. Kan du finne kloratom? Kilde: Marinavladivok [CC0].
Pimecrolimus, pleide å behandle atopisk dermatitt. Kan du finne kloratom? Kilde: Marinavladivok [CC0]. Halomon, mulig antitumoralt middel og alkylhalogenid av tangsalgae Portieria hornemannii, en naturlig kilde. Kilde: Jü [Public Domain]
Halomon, mulig antitumoralt middel og alkylhalogenid av tangsalgae Portieria hornemannii, en naturlig kilde. Kilde: Jü [Public Domain]
Merk at i disse fem medikamentene er det minst en lenke av CHO -typen2-X eller ch-x; Det vil si at halogen er knyttet til en sp -karbon3.
Kjølemedier
Den berømte Freón-12 kjølemediet (chcif2), Som andre fluoroalcanos eller hydrofluorokarboner, erstattet de ammoniakk og klorofluorokarboner (CFC) i denne funksjonen fordi de til og med var ikke -flyktige eller giftige stoffer, ødela ozonlaget; Mens Freón-12, fordi den er mer reaktiv, blir ødelagt før du når slike høyder.
Referanser
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Clark Jim. (14. juli 2016). Bruk av alkylhalider. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Gál, f., Bucher, c., & Burns, n. Z. (2016). Chirale alkylhalogenider: Underutforskede motiver i medisin. Marine medisiner, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkylhalogenider. Hentet fra: Chemed.Chem.Purdue.Edu
- Patkar Prachi. (16. juli 2017). Alt om alkylhalogenider: egenskaper, bruksområder og mye mer. Science struct. Gjenopprettet fra: Sciencestruck.com
- R. skip. (2016). Alkylhalogenider. Gjenopprettet fra: hyperfysikk.PHY-ASTR.GSU.Edu
- Læringsguide for kapittel 9 - Alkylhalogenider i. Gjenopprettet fra: kaktus.Dixie.Edu
- Q.TIL. Eduardo Vega Barrios. (s.F.). Lei Halogenuros: Egenskaper, bruksområder og applikasjoner. [PDF. Gjenopprettet fra: cvonline.Uaeh.Edu.MX

