Kadmium (CD) historie, egenskaper, struktur, bruk

- 3527
- 874
- Anders Mathisen
Han kadmium (CD) er en overgangs- eller post -overgangsmetall av atomnummer 48 og sølvfarge. Det er formbar og duktil, med relativt lave smelte- og kokepunkter. Kadmium er et sjeldent element og har knapt en konsentrasjon på 0,2 g / tonn jordskorpe.
La Greenockita (CDS) er den eneste viktige MENA i kadmium som presenterer en intens gul farge. Kadmium er assosiert med sink i sfaleritten (ZNS), som inneholder mellom 0,1 og 03 % kadmium som CD -kation2+.
 Kadmiumkrystaller. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Kadmiumkrystaller. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Når du behandler sphannel for å skaffe, støperi og raffinering av sink, oppnås kadmium sekundært, dette er den viktigste produksjonskilden.
Dette metallet ble oppdaget i 1817, uavhengig av Friedrich Stromayer og Karl Hermann. Stromayer døpte det nye elementet med navnet kadmium, stammer fra det latinske ordet "kadmia", et begrep som calamine (sinkkarbonat) var kjent (sinkkarbonat).
 Kadmium er et kjemisk element med CD -symbolet og atomnummeret er 48. Kilde: Albedo-UKR CC BY-SA 2.5 (http: // creativecommons.Org/lisenser/by-SA/2.5/)
Kadmium er et kjemisk element med CD -symbolet og atomnummeret er 48. Kilde: Albedo-UKR CC BY-SA 2.5 (http: // creativecommons.Org/lisenser/by-SA/2.5/) Kadmium er et element av stort nytteverdi og mange anvendelser, for eksempel antikorrosivt jern, stål og ikke -personlige metaller; bruk som pigment; PVC stabilisering; element i legeringer brukt i sveiser; Nikkel-kadmiumbatterier opplades, etc.
Imidlertid er det et veldig giftig element som forårsaker alvorlig skade på lungene, nyrene og beinene, og til og med en kreftfremkallende virkning har blitt indikert, og det er grunnen til. Men til tross for dette har det fortsatt å bli nøye brukt i noen applikasjoner.
[TOC]
Historie
- Dobbel oppdagelse
Kadmium ble oppdaget av Friedrich Stromayer, en tysk kjemiker, i 1817 i en sinkkarbonatprøve (Calamina). Samme år, k. S. L. Hermann og J. C. H. Roloff gjorde den samme oppdagelsen, uavhengig av, i et eksperiment utført med sinksulfid.
Det har blitt påpekt at Stromayer gjorde sin oppdagelse under oppfyllelsen av en regjeringssøknad for å inspisere apotekene i byen Hildesheim, Tyskland. Sinkoksid, som nå, ble brukt i behandlingen av visse hudforhold.
Det ser ut til at apotek ikke utstedte sinkoksid, men i stedet solgte sinkkarbonat: råstoff for sinkoksidproduksjon. Sinkoksidprodusenter hevdet at sinkkarbonatet ble oppvarmet et gult "sinkoksid".
Kadmiumoksid
De kunne ikke selge dette "sinkoksid", siden fargen på forbindelsen normalt var hvit; Og i stedet solgte de sink karbonat, også hvitt. Gitt denne situasjonen, bestemte Stromayer seg for å studere det påståtte gule sinkoksid.
For å gjøre dette, varmet han prøver av sinkkarbonat (kalamin), og det var et gult sinkoksid, som informert. Etter å ha analysert det, konkluderte han med at den gule fargen var et produkt på grunn av tilstedeværelsen av et metallisk oksid av et nytt element.
Etter å ha trukket ut dette nye metalliske oksydet, produserte den sin reduksjon og oppnådde kadmiumisolasjon. Stromayer bestemte sin tetthet og oppnådde en verdi på 8,75 g/cm3, I nærheten av verdien som er kjent for øyeblikket for denne parameteren (8,65 g/cm3).
På samme måte påpekte Stromayer at det nye elementet hadde et utseende som ligner platina, og at det også var til stede i mange sinkforbindelser, og inkluderende i den rensede sink.
Stromayer foreslo navnet "Cadmium" fra den latinske stemmen "Cadmia", navn som ble kalt Calamina, ZNCO3.
Kadmium i sinksulfid
Karl Hermann (1817) fant en uenet gul farge da han behandlet sinksulfid og trodde det kunne være en forurensning med arsen. Men når denne muligheten ble kastet, innså Hermann at han var i nærvær av et nytt element.
- applikasjoner
1840-1940
I 1840 -årene begynte bruken av kadmium å bli utnyttet som et pigment. Den britiske farmasøytiske kodeksen indikerer i 1907 bruken av kadmiumjodid som medisin for å behandle "forstørrede ledd", skurrende kjertler og sabañoner.
På 1930- og 1940 -tallet var kadmiumproduksjonen bestemt til platina av stål og jern for å beskytte dem mot korrosjon. På 1950 -tallet ble kadmiumforbindelser brukt, for eksempel kadmiumsulfid og kadmiumselenid som røde, oransje og gule pigmenter kilder.
1970-1990
På 1970- og 1980 -tallet ble det oppdaget at kadmiumkadmium og stearate forbindelser var PVC -stabilisatorer, noe som ga en økning i kadmium etterspørselen. Imidlertid miljøforskrifter på grunn av toksisiteten til kadmium.
På 1980- og 1990-tallet sluttet kadmiumet å bruke mange av bruksområdene, men deretter økte produksjonen med opprettelsen av de oppladbare batteriene til nikkel-kadmium, som kom til å representere 80 % av forbruket av kadmium i USA.
Kan tjene deg: bruk og applikasjoner av alceansFysiske og kjemiske egenskaper ved kadmium
Utseende
SLILLET OG MYD GRAY -GRAY HVIT. Det blir sprøtt ved eksponering for 80 ºC, og kan kutte med en kniv. Er formbar og ruller kan dannes med ham.
Standard atomvekt
112.414 u
Atomnummer (z)
48
Elementkategori
Post -overtransisjonsmetall, vekselvis betraktet som et overgangsmetall. Definisjonen av IUPAC av et overgangsmetall er en hvis atomer har en ufullstendig undercap eller som kan føre til kationer med en ufullstendig subcap.
I følge den definisjonen er kadmium ikke et overgangsmetall siden CD -kationen2+ Den har sine 4D -orbitaler helt fulle av elektroner (4D10).
Lukt
Toalett
Smeltepunkt
321.07 ºC
Kokepunkt
767 ºC
Tetthet
Omgivelsestemperatur: 8,65 g/cm3
Ved smeltepunktet (væske): 7.996 g/cm3
Fusjonsvarme
6.21 kJ/mol
Fordampningsvarme
99,87 kJ/mol
Molar kalorikapasitet
26,020 J/(mol · K)
Elektronegativitet
1.6 på Pauling -skalaen
Ioniseringsenergier
Først: 867,8 kJ/mol (CD+ gassform)
For det andre: 1631,4 kJ/mol (CD2+ gassform)
Tredje: 3616 kJ/mol (CD3+ gassform)
Termisk ledningsevne
96,6 w/(m · k)
Motstand Elektrisk
72,7 nΩ · m ved 22 ° C
Hardhet
2.0 på MOHS -skalaen. Det er et metall, selv om det er tett, betydelig mykt.
Stabilitet
Det oksideres sakte med våt luft for å danne kadmiumoksid, noe som plager den metalliske lysstyrken. Det er ikke brannfarlig, men i form av støv kan det brenne og oppleve selvnetting.
Selvretning
250 ºC for kadmium er en støvform.
Brytningsindeks
1.8 til 20 ºC
Reaktivitet
Kadmium kan brenne i luften for å danne kadmiumoksid (CaO), et brunt amorft støv, mens den krystallinske formen er mørkerød.
Kadmium reagerer raskt med fortynnet salpetersyre, og sakte med varm saltsyre. Han er også i stand til å reagere med svovelsyre, men reagerer ikke med alkalier. I alle disse reaksjonene dannes kadmiumsalter av deres tilsvarende anioner (CL-) eller oksoanjoner (nei3- Og så42-).
Elektronisk struktur og konfigurasjon
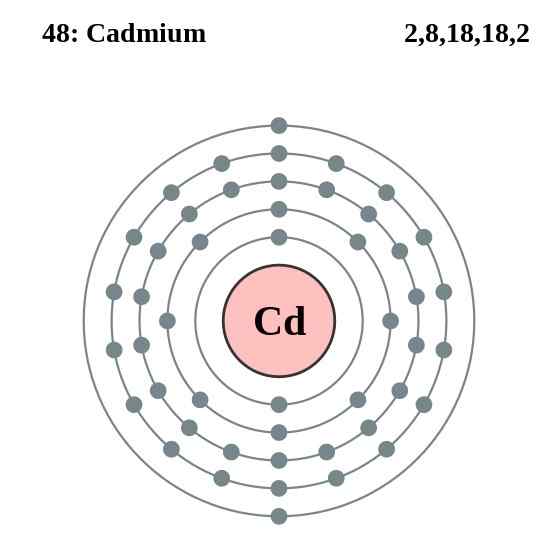 Kadmiumelektronlagsdiagram, element 48 i den periodiske tabellen. Kilde: Pumbaa (originalt arbeid av Greg Robson) CC BY-SA 2.0 (http: // creativecommons.Org/lisenser/by-SA/2.0/)
Kadmiumelektronlagsdiagram, element 48 i den periodiske tabellen. Kilde: Pumbaa (originalt arbeid av Greg Robson) CC BY-SA 2.0 (http: // creativecommons.Org/lisenser/by-SA/2.0/) Kadmiumatomene i glasset deres etablerer en metallbinding fra valenselektronene, som er lokalisert i 4D- og 5S -orbitalene i henhold til deres elektroniske konfigurasjon:
[Kr] 4d10 5s2
Selv om 4D -orbitaler er fulle av elektroner, og at det også kan tenkes at "elektronhavet" er rikelig med å være sterkt kohesende CD -atomer, i virkeligheten er interaksjonene svake. Dette kan demonstreres eksperimentelt med det lave smeltepunktet (321 ºC), sammenlignet med andre overgangsmetaller.
Derfor, og andre kjemiske grunner, blir kadmium noen ganger ikke betraktet som et overgangsmetall. Det er så mange elektroner (tolv) involvert i metallbindingen deres, som begynner å forstyrre deres negative frastøtninger; som sammen med energiforskjellen mellom 4D-orbitaler fulle og 5s, svekker CD-CD-interaksjonen.
CD -atomer ender opp med å definere en kompakt sekskantet krystallinsk struktur (HCP), som ikke lider av faseoverganger før smeltepunktet. Når kadmium HCP -krystaller gjennomgår et trykkekvivalent med 10 GPa, er strukturen bare deformert; Men uten å rapportere noen faseendring.
Oksidasjonstall
Kadmium kan ikke miste de tolv elektronene i Valencia; Faktisk kan du ikke engang miste en av 4D -orbitalene, mer stabil i energi sammenlignet med 5s orbital. Derfor kan du bare miste de to orbitale elektronene 5s2, å være et divalent metall; Som med sink, kvikksølv og alkalisk metaller (MR. Scholambara).
Når eksistensen av CD -kationen antas i forbindelsene2+, Det sies da at kadmium har et +2 oksidasjonsnummer eller tilstand. Dette er dets viktigste oksidasjonsnummer. Følgende forbindelser inneholder for eksempel kadmium som +2: CDO (CD2+ENTEN2-), CDCL2 (CD2+Cl2-), CDSO4 (CD2+SW42-) og CD (nei3)2.
I tillegg til dette oksidasjonsnummeret, er det også +1 (CD+) og -2 (CD2-). Oksidasjonsnummeret +1 er observert i CD -dikasjonen22+, der hvert kadmiumatom har en positiv belastning. I mellomtiden er -2 er ganske rart, og vil søke om anionen "Cadmuro".
Hvor er det og skaffer seg
 Greenockita -krystaller. Kilde: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Greenockita -krystaller. Kilde: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Kadmium er et sjeldent element som har en konsentrasjon på 0,2 g / tonn av jordskorpen. Det eneste viktige kadmiummineralet er Greenockita (CDS), som ikke kan utnyttes fra gruvedrift og kommersielt synspunkt.
Kan tjene deg: flokkulering: reaksjon, typer, applikasjoner, eksemplerKadmium er assosiert med sink i Spheny -mineralet (ZNS), som vanligvis inneholder en konsentrasjon som varierer mellom 0,1 % og 0,3 %; Men i noen tilfeller kan konsentrasjonen av kadmium i sfaleritten nå 1,4 %.
Behandlede bergarter for å oppnå fosforgjødsel kan ha en kadmiumkonsentrasjon på 300 mg / kg gjødsel. Kull kan også inneholde små, men betydelige mengder kadmium.
En viktig kilde til kadmium er de vulkanske utslippene som kan bringe kadmium til overflatevannet. Bruken av fosforgjødsel i jordbruksbruk av jordsmonn har ført til kadmiumforurensning.
Kadmium til stede i sure jordsmonn er absorberbar av grønnsaker. Noen av grønnsakene brukes av mennesket som mat, noe som forklarer hvordan vann- og matinntak er den viktigste kilden til kadmiuminntekt hos mennesker som ikke er profesjonelt utsatt eller røyking.
Sphalerittbehandling
Under gruvedriften, smelte og raffinering av sink som er til stede i sfaleritten, oppnås kadmium vanligvis som et sekundært produkt. En lignende hendelse skjer også, selv om det i mye mindre grad under kobber- og blybehandling.
På samme måte kan små mengder kadmium oppnås ved resirkulering av jern og stålavfall.
Sprailen blir utsatt for toast slik at sinksulfid blir oksydet, ZnO. Den samme reaksjonen blir lidd av kadmiumsulfid:
2 Zns + 3 o2 → 2 ZnO + 2 Så2
Hvis denne blandingen av oksid blir oppvarmet med kull, vil de bli redusert til sine respektive metaller:
ZnO + CO → Zn + CO2
På samme måte kan sink og kadmium produseres ved elektrolyse når du løser opp oksider i svovelsyre.
En av de to metodene genererer en femti forurenset med kadmium. Når smelter kan kadmium kan destilleres i et vakuum på grunn av det nedre smeltepunktet (321 ° C) sammenlignet med den med CINC (420 ° C).
Isotoper
Blant de naturlige og stabile isotoper av kadmium har vi, med deres respektive forekomster her på jorden:
-106CD (1,25%)
-108CD (0.89%)
-110CD (12,47%)
-111CD (12,8%)
-112CD (24,11%)
-114CD (28,75%)
-113CD (12,23%)
Han 113CD er radioaktiv, men på grunn av den store verdien av halvlivet (t1/2= 7,7 · 10femten år), kan betraktes som stabil. Og så er det 116CD, også radioaktiv, med en halvliv på 3,1 · 1019 år, så det kan betraktes som en stabil isotop, som representerer 7,51 % av kadmium.
Merk at den gjennomsnittlige atommassen er 112.414 U, nærmere 112 enn 114. Eksistensen av en dominerende isotop over de andre blir ikke observert i kadmium.
Risiko
Generell
Kadmiumabsorpsjon skjer hovedsakelig med mat, spesielt lever, sopp, skalldyr, pulverisert kakao og tørre alger.
En emblematisk sak skjedde i Kina i forrige århundre, hvor det var en viktig forurensning med kadmium i befolkningen. Kadmiumforurensning skyldtes dens høye konsentrasjon i ris, forårsaket av tilstedeværelsen av kadmium i kornproduksjons jordsmonn.
En røyker har et gjennomsnittlig inntak på 60 ug / dag. Den maksimale konsentrasjonen av kadmium som er tillatt i blodet er 15 ug / dag. Ikke -røykere har en konsentrasjon av kadmium i blodet rundt 0,5 ug / l.
Lungene absorberer mellom 40 og 60 % av kadmium som er til stede i tobakksrøyk. Kadmium som absorberes i lungene blir transportert i blodet, og danner komplekser med proteiner, cystein og glutasjon, som deretter ender i leveren, nyrene osv.
En akutt kadmiuminhalering kan forårsake symptomer som ligner de som er observert i en influensatprosess; som kulde, feber og muskelsmerter, å kunne forårsake lungeskader. I mellomtiden kan kronisk eksponering for kadmium forårsake lungesykdom, nyrer og bein.
Effekt på nyrer
I nyrene forårsaker kadmium vanligvis en endring i fosfor og kalsiummetabolisme, beviset av en økning i produksjonen av nyreberegninger. I tillegg forårsaker det nyreskade manifestert i utseendet i urinen til retinoltransportproteinet og β-2-mikroglobulin.
Reproduksjonseffekt
Morseksponering for kadmium er assosiert med en lav vekt av barnet ved fødselen og en økning i frekvensen av spontane aborter.
Beinskade
Kadmium er relatert i Japan til tilstedeværelsen av itai -itai sykdom i forrige århundre. Denne sykdommen er preget av lav benmineralisering, beinfrihet med høy bruddhastighet, økt osteoporose og bein smerte.
Kan tjene deg: CD3: Kjennetegn, funksjonerKarsinogenese
Selv om rotter eksperimenter etablerte en sammenheng mellom kadmium og prostatakreft, har det ikke blitt demonstrert hos mennesker. En sammenheng mellom kadmium og nyrekreft har blitt bevist, og har også vært knyttet til lungekreft.
applikasjoner
Nikkel-kadmium oppladbare bakterier
 Forskjellige batterier eller Ni-CD-batterier. Kilde: Boffy B via Wikipedia.
Forskjellige batterier eller Ni-CD-batterier. Kilde: Boffy B via Wikipedia. Kadmiumhydroksid ble brukt som katode i Ni-CD-batterier. Disse ble brukt i jernbane- og luftfartsindustrien, så vel som i instrumenter for kollektiv bruk som inkluderer mobiltelefoner, videokamera, bærbare datamaskiner, etc.
Kadmiumforbruk for utdyping av Ni-CD-batterier representerte 80 % av kadmiumproduksjonen. På grunn av toksisiteten til dette elementet, er Ni-CD-batterier imidlertid gradvis erstattet av nikkel-metallhydridbatterier.
Pigmenter
 Kadmiumrød. Kilde: Marco Almbauer [Public Domain]
Kadmiumrød. Kilde: Marco Almbauer [Public Domain] Kadmiumsulfid brukes som gult pigment og kadmium seleniuro som et rødt pigment, kjent som cadmio rød. Disse pigmentene er preget av deres glans og intensitet, så de har blitt brukt i plast, keramikk, glass, emaljer og kunstneriske farger.
Det har blitt påpekt at maleren Vincent Van Gogh brukte kadmiumpigmenter i maleriene hans, noe som tillot ham å oppnå en rekke røde, oransje og knallgule.
Fargen på kadmiumpigmenter må dempes før de blir malt med oljer eller blandes i akvareller og akryl.
Fjernsyn
Komponenter som inneholdt kadmium ble brukt i fosfor av svart -hvitt -TV -er, så vel som i blå og grønne kamper for farge -TV -bildørrør.
Fosfor var en del av skjermen som ble strålt av katodestråler, og var ansvarlig for bildedannelse. Kadmium, til tross for dets toksisitet, har begynt å bli brukt på de QLED -TV -ene i nyere skapelse.
PVC -stabilisering
Kadmiumforbindelser dannet med karboksylat, Laurerate og Steereate ble brukt som polyvinylkloridstabilisatorer, siden de forsinker nedbrytningen produsert ved eksponering for varme og ultrafiolett lys som bryter ned PVC under produksjonsprosessen.
På grunn av kadmiumets toksisitet, igjen, er PVC-stabilisatorene forent til kadmium blitt erstattet av andre stabilisatorer, for eksempel barium, kalsium-sink og organostaño.
Legeringer
Kadmium har blitt brukt i lagerlegeringer på grunn av sin høye motstand mot tretthet og lav friksjonskoeffisient. Kadmium har et relativt lavt smeltepunkt, så det brukes i lavmeltelegeringer, og er komponent i tillegg til mange typer sveising.
Kadmium kan også brukes i legeringer av elektrisk ledningsevne, termisk ledningsevne og elektrisk kontakt.
Dekke
Kadmium brukes til stålbeskyttelse, aluminium og andre ikke -gere -fikseringselementer, samt mobile deler. Kadmiumbelegg leverer korrosjonsbeskyttelse i de saltvann og alkaliske medier. I tillegg fungerer det som et smøremiddel.
Kadmium brukes også i mange elektriske og elektroniske anvendelser som trenger korrosjonsmotstand og lav elektrisk resistivitet.
Atomreaktorer
Kadmium brukes i kjernefysiske reaktorer for deres evne til å fange nøytroner, noe som gjør det mulig å kontrollere overflødig nøytroner produkt av kjernefysisk fisjon, og unngår ytterligere kjernefysiske sprekker.
Halvledere
Seleniuro og kadmium Telluriuro er forbindelser som oppfyller funksjonen til halvledere i påvisning av lys og i solceller. HGCDTE er følsom for infrarødt lys og brukes som bevegelsesdetektor, samt en bryter for fjernkontrollenheter.
biologi
 He-CD Laser Light. Kilde: Snarere anonym (https: // www.Flickr.com/bilder/[e -post beskytter]/35766549)
He-CD Laser Light. Kilde: Snarere anonym (https: // www.Flickr.com/bilder/[e -post beskytter]/35766549) Helium-CD griper inn i dannelsen av en blå-fiolett laserstråle av en bølgelengde som varierer mellom 325 og 422 nm, brukbar i fluorescensmikroskop.
Kadmium brukes i molekylærbiologi for å blokkere kalsiumkanaler, avhengig av membranpotensialet.
Referanser
- Wikipedia. (2019). Kadmium. Hentet fra: i.Wikipedia.org
- Jungle v. R. & et al. (2014). Høyt trykk og temperaturstruktur av væske og fast CD: Implikasjoner for smeltekurven til CD. Gjenopprettet fra: ResearchGate.nett
- Dr. Deig Stewart. (2019). Kadmiumelementfakta. Gjenopprettet fra: Chemicool.com
- Nasjonalt senter for bioteknologiinformasjon. (2019). Kadmium. PubChem -database. CID = 23973. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Godt, J., Scheidig, f., Grosse-Siestup, ca., Esche, v., Brandenburg, p., Reich, a., & Groneberg, D. TIL. (2006). Toksisiteten til kadmium og resulterende farer for menneskers helse. Journal of Occupational Medicine and Toxicology (London, England), 1, 22. Doi: 10.1186/1745-6673-1-22
- Ros Rachel. (30. juli 2018). Fakta om Camium. Gjenopprettet fra: Livescience.com
- Redaktørene av Enyclopaedia Britannica. (6. september 2018). Kadmium. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- International Cadmium Association. (s.F.). Kadmiumapplikasjoner. Gjenopprettet fra: kadmium.org
- Lentech b. V. (2019). Kadmium. Gjenopprettet fra: Lentech.com
- « Basale noder funksjoner, anatomi og patologier
- Historieparasitologi, hva studerer du?, grener, konsepter »

