Varmeabsorberte formler, hvordan du beregner det og løste øvelser

- 1638
- 223
- Prof. Joakim Johansen
Han absorbert varme Det er definert som overføring av energi mellom to kropper ved forskjellige temperaturer. Den med lavere temperatur absorberer varmen enn ved en høyere temperatur. Når dette skjer, øker den termiske energien til stoffet som absorberer varmen, og partiklene som komponerer det vibrerer raskere, og øker den kinetiske energien.
Dette kan oversette til en økning i temperaturen eller en tilstandsendring. For eksempel bevege deg fra fast til væske, for eksempel is når du smelter i kontakt med vann eller brus ved romtemperatur.
 Metalltesken absorberer varm kaffevarme. Kilde: Pixabay.
Metalltesken absorberer varm kaffevarme. Kilde: Pixabay. Takket være varme er det også mulig at objekter endrer dimensjoner. Termisk utvidelse er et godt eksempel på dette fenomenet. Når de fleste stoffer blir oppvarmet, opplever de vanligvis en økning i dimensjonene.
Et unntak fra dette er vann. Den samme mengden flytende vann øker volumet når det avkjøles under 4 ºC. I tillegg kan temperaturendringer også oppleve endringer på nivået av tettheten, noe som også er veldig observerbart når det gjelder vann.
[TOC]
Hva er og formler
Når det. Imidlertid hadde varmen i lang tid sine egne enheter: kalori.
Fortsatt i dag brukes denne enheten til å kvantifisere energiinnholdet i mat.
Kalorier
Kalori, forkortet som Kalk, Det er mengden varme som er nødvendig for å heve temperaturen på 1 gram vann med 1 ºC.
På det nittende århundre gjennomførte Sir James Prescott Joule (1818 - 1889) et kjent eksperiment der han klarte å transformere mekanisk arbeid til varme, og oppnådde følgende ekvivalens:
1 kalori = 4.186 Joules
I britiske enheter kalles varmeenheten BTU (Britisk termisk enhet), som er definert som mengden varme som trengs for å heve temperaturen på et kilo vann i 1 ºF.
Det kan tjene deg: Kalibreringskurve: Hva er det for, hvordan du gjør det, eksemplerEkvivalensen mellom enhetene er som følger:
1 BTU = 252 kalorier
Problemet med disse gamle enhetene er at mengden varme avhenger av temperaturen. Det vil si at det ikke er det samme som kreves for å passere fra 70 ºC til 75 ° C enn den som kreves for å varme opp vannet fra 9 ° C til 10 ºC, for eksempel.
Det er grunnen til at definisjonen vurderer godt definerte intervaller: 14.5 til 15.5 ° C og 63 til 64 ° F for henholdsvis kalori og BTU.
Hva som avhenger av mengden varme som er absorbert?
Mengden absorbert varme som samler et materiale avhenger av flere faktorer:
- Masse. Jo høyere massen, jo mer varmen er den i stand til å absorbere.
- Stoffegenskaper. Det er stoffer som avhengig av deres molekylære eller atomstruktur, er i stand til å absorbere mer varme enn andre.
- Temperatur. Det kreves å tilsette mer varme for å oppnå en høyere temperatur.
Mengden varme, betegnet som Q, Det er proporsjonalt med de beskrevne faktorene. Derfor kan du skrive som:
Q = m.c.ΔT
Hvor m Det er massen til objektet, c er en konstant kalt spesifikk varme, en iboende egenskap av stoffet og ΔT Det er temperaturvariasjonen oppnådd ved å absorbere varme.
Δt = tF - Tenten
Denne forskjellen har et positivt tegn, siden det å absorbere varme er å forvente det TF > Tenten. Dette skjer med mindre stoffet opplever en faseendring, for eksempel vann når dampvæsken passerer. Når vannet koker, forblir temperaturen konstant ved omtrent 100 ºC, uavhengig av hvor raskt det koker.
Hvordan beregne det?
Ved å kontakte to objekter ved en annen temperatur, når de begge de termiske likevekten etter en stund. Så temperaturene blir utjevnet og varmeoverføring opphører. Det samme skjer hvis mer enn to objekter er i kontakt. Etter en viss tid vil alle være på samme temperatur.
Det kan tjene deg: magnetisering: orbital og spinn magnetisk øyeblikk, eksemplerForutsatt at objekter i kontakt danner et lukket system, som varmen ikke kan slippe unna, brukes prinsippet om energibesparing, så det kan bekreftes at:
Q absorbert = - q Sceding
Dette representerer en energibalanse, lik den for inngangene og utgiftene til en person. Det er grunnen til at den avsatte varmen har et negativt tegn, siden for objektet som gir, er den endelige temperaturen lavere enn den første. Derfor:
Δt = tF - Tenten < 0
Ligningen q absorbert = - q Sceding Det brukes når to objekter er i kontakt.
Energibalansen
For å utføre energibalansen er det nødvendig å skille gjenstandene som absorberer varme fra de som gir, da:
Σ qk= 0
Det vil si at summen av energigevinster og tap i et lukket system må være lik 0.
Den spesifikke varmen til et stoff
For å beregne mengden absorbert varme, må du kjenne den spesifikke varmen til hvert deltakende stoff. Dette er mengden varme som trengs for å øke temperaturen på 1 g materiale med 1 ºC. Enhetene i det internasjonale systemet er: Joule/kg . K.
Det er tabeller med den spesifikke varmen med mange stoffer, generelt beregnet ved å bruke et kalorimeter eller lignende verktøy.
Et eksempel på hvordan du beregner den spesifikke varmen til et materiale
250 kalorier er påkrevd for å heve temperaturen på en metallring på 20 til 30 ºC. Hvis ringen har en masse på 90 g. Hva er den spesifikke varmevarmen i SI -enheter?
Løsning
Enhetene blir først konvertert:
Q = 250 kalorier = 1046.5 J
m = 90 g = 90 x 10-3 kg
Kan tjene deg: Elastiske sjokk: I en dimensjon, spesielle tilfeller, øvelser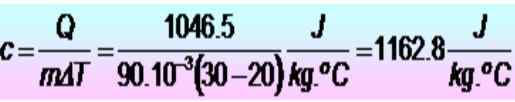
Trening løst
En aluminiumskopp inneholder 225 g vann og en 40 g kobberuritator, alt ved 27 ° C. En prøve på 400 g sølv ved en initialtemperatur på 87 ° C er plassert i vannet.
Opprøreren brukes til å røre blandingen til den når sin endelige likevektstemperatur på 32 ° C. Beregn massen av aluminiumskoppen, med tanke på at det ikke er noen varmetap mot miljøet.
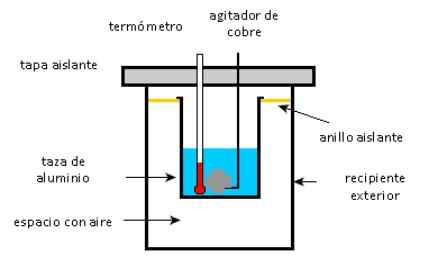 Ordning med et kalorimeter. Kilde: Solidswiki.
Ordning med et kalorimeter. Kilde: Solidswiki. Nærme seg
Som nevnt ovenfor, er det viktig å skille gjenstandene som gir varme fra de som absorberer:
- Aluminiumskopp, kobber- og vannrøring absorberer varme.
- Sølvprøven gir varme.
Data
Den spesifikke varmen for hvert stoff leveres:
- Sølv: C = 234 J/kg. ºC
- Kobber: C = 387 J/kg. ºC
- Aluminium C = 900 J/kg. ºC
- Vann C = 4186 J/kg. ºC
Varmen som er absorbert eller tildelt av hvert stoff beregnes med ligning:
Q = m.c.λT
Løsning
Sølv
Q Sceding = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Kobberbegrunnelse
Q absorbert = 40 x 10 -3 . 387 x (32 - 27) j = 77.4 J
Vann
Q absorbert = 225 x 10 -3 . 4186 x (32 - 27) J = 4709.25 J
Aluminiumskopp
Q absorbert = m aluminium . 900 x (32 - 27) J = 4500 .m aluminium
Gjør bruk av:
Σ qk= 0
77.4 + 4709.25 + 4500 .m aluminium = - (-5148)
Endelig blir aluminiumsmassen ryddet:
m aluminium = 0.0803 kg = 80.3 g
Referanser
- Giancoli, d. 2006. Fysikk: Prinsipper med applikasjoner. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Fysikk: En titt på verden. 6ta Forkortet utgave. Cengage Learning. 156 - 164.
- Rex, a. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysikk med moderne fysikk. 14th. Volum1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9na Cengage Learning. 362 - 374
- « Adeninstruktur, biosyntese, funksjoner
- Makromolekyler Karakteristikker, typer, funksjoner og eksempler »

