Forbrenningsvarme

- 4541
- 1457
- Oliver Christiansen
Hva er forbrenningsvarmen?
Han Forbrenningsvarme Det er energien som frigjøres når en viss mengde materiale, vanligvis en mol, reagerer eksotermisk med oksygenet i luften. Det er en essensiell termokjemiegenskap i karakterisering av drivstoff, alkoholer og spesielt hydrokarboner, som butan og metan.
Når et stoff brenner lys og varme, kan energi som kan brukes til å jobbe på andre kropper. For eksempel er den varme som genereres i stand til å varme opp store mengder vann, hvis damp presser omgivelsene og virker noen elektriske generatorer; eller ganske enkelt, ytterligere oppvarming av dampet mat.
 Varmen som genereres av forbrenning av kjøkkengassen brukes til å varme opp kullene og maten
Varmen som genereres av forbrenning av kjøkkengassen brukes til å varme opp kullene og maten Forbrenningsvarme varierer mellom alle stoffer, selv om dens kjemiske natur i hovedsak er den samme. Denne variasjonen tilsvarer relativ stabilitet, det vil si: jo mer ustabil en forbindelse, jo større er energien som frigjøres, representert som -ΔH. Det negative symbolet betyr at varmen strømmer ut.
Ulike -ΔH -verdier brukes til å sammenligne den relative stabiliteten mellom forskjellige alkaus og deres isomerer. Det lar det også være stabilt.
Mål
For å måle forbrenningsvarmer er det nødvendig med en kalorimetrisk pumpe. Innenfor det reagerer stoffet med oksygen ved aktivering av en elektrisk gnist.
Deretter varmes den frigjørte varmen opp et volum av vann som omgir prøveverden, og måler temperaturen før og etter forbrenning, samt massen av vann og drivstoff.
Så energien som frigjøres vil være lik:
Ceh2o·mH2Eller · Δt
Hvoreh2o Det er den spesifikke varmen av vann, 4.184 J/g · ºC, mH2Eller massen av vannet, og Δt dens temperaturendring. Til slutt er denne varmen, uttrykt i joule- eller kalorienheter, delt mellom massen eller molene til drivstoffet som er plassert inne i kalorimetrisk pumpe, for å oppnå forbrenningsvarmen per enhet av masse eller mol.
Kan tjene deg: Hva er den mekaniske ekvivalenten til varme?Metaller kombinerer ikke seg selv, men oksiderer i forskjellige hastigheter avhengig av temperaturen de blir utsatt. Varmen de produserer er foraktelig for å måles på samme måte som den gjøres med hydrokarboner og annet drivstoff. De er derfor ikke brennbare stoffer.
Potensielle energier
Under forbrenning er koblingene ødelagte for å danne nye, mer stabile. Energien som er inneholdt i alle et molekylkoblinger er uavhengig av bevegelsen, så det er en potensiell energi.
Jo større potensiell energi, jo mer ustabilt vil molekylet være, og derfor vil det frigjøre mer varme når de nye koblingene er etablert.
For å vite hvilke nøyaktig disse nye koblingene er, bør produktene fra en fullstendig forbrenning vurderes: CO2 For karbon, h2Eller for hydrogen, og ikke2 For nitrogen. Når det gjelder hydrokarboner, vil deres fullstendige forbrenning generere støkiometriske blandinger av CO2 og h2ENTEN.
Begge molekyler, CO2 og h2Eller, de har veldig lave potensielle energier, fordi koblingene deres (o = c = o og h-o-h) er veldig stabile sammenlignet med hydrokarbonkoblingene de kom (c-h og c-c).
Relativ stabilitet
Potensielle energier er fritt. Men variasjonene deres er ikke, det vil si forskjellen på disse energiene mellom produktene (CO2 og h2O) og reaktanter (hydrokarboner).
Det er grunnen til at du har disse variasjonene, eller hva som er det samme, deres forbrenning varmer, kan du vite hva som er den relative stabiliteten mellom et sett med hydrokarboner eller isomerer.
Stenger
Alkanene kan være lineære, forgrenede eller sykliske. Når det gjelder lineære alkaner, varierer dens forbrenningsvarme avhengig av lengden på kjedene; det vil si at det kommer an på hvor mange enheter ch2 ha. Tenk på eksemplet på n-heksan, n-Heptano og n-oktan:
Det kan tjene deg: jod: historie, egenskaper, struktur, innhenting, risiko, brukCh3(Ch2)4Ch3, -ΔH = 4163 kJ/mol
Ch3(Ch2)5Ch3, -ΔH = 4817 kJ/mol
Ch3(Ch2)6Ch3, -ΔH = 5471 kJ/mol
Du kan se at forbrenningsvarmen varierer med 654 kJ/mol. Dette betyr at hvert Cho2 som tilsettes kjeden øker forbrenningsvarmen med en hastighet på 654 kJ/mol. Dermed nonano, ch3(Ch2)7Ch3, Det vil ha en forbrenningsvarme lik 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Dette er det samme som å si at lengre kjeder har større potensielle energier, og derfor er de mer ustabile.
Forgrenede alkaner er mer stabile enn lineære, og dette er trukket fra deres forbrenningsvarmer. Tenk nå på tre isomerer av oktanen:
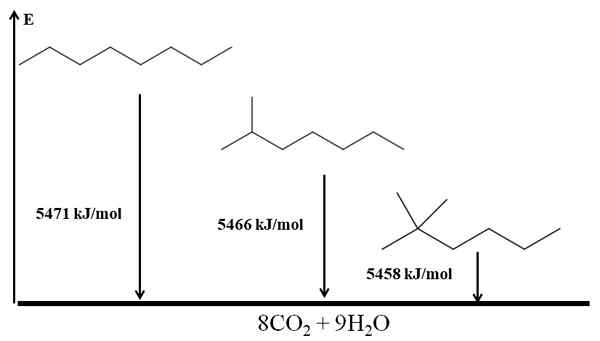 Forbrenning varmer opp for tre oktanisomerer. Kilde: Gabriel Bolívar via Molview.
Forbrenning varmer opp for tre oktanisomerer. Kilde: Gabriel Bolívar via Molview. Han n-Octano er den mest ustabile fordi forbrenningsvarmen er den største (5471 kJ/mol). På den annen side er isomerer 2-metylheptano og 2,2-dimetylhexan. 2.2-dimetylhexan er den mest stabile for å være den mest forgrenede av de tre isomerer.
Alkenes
Den relative stabiliteten til alkener kan også oppnås fra deres forbrenningsvarmer. Tenk for eksempel fire Butenus -isomerer:
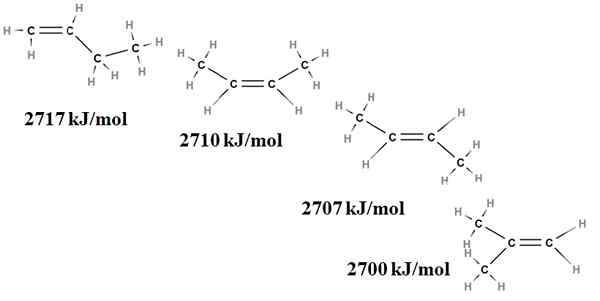 Forbrenning varmer for Buteno -isomerer. Kilde: Gabriel Bolívar via Molview.
Forbrenning varmer for Buteno -isomerer. Kilde: Gabriel Bolívar via Molview. Her snakker vi ikke lenger om forgreninger, men om graden av erstatning av dobbeltbindingen, C = C og dens van der Waals spenninger; det vil si av elektroniske og steriske frastøtninger mellom to klumpete grupper som ligger på samme side av dobbeltbindingen.
Den første isomeren, 1-buten, er den mest ustabile fordi dobbeltbindingen er mindre erstattet (h2C = c). Dette gjenspeiles i forbrenningsvarmen på 2717 kJ/mol.
Kan tjene deg: klorogensyreTil høyre er CIS-2-buten, litt mer stabil fordi dobbeltbindingen er mer erstattet. Men trans-2-buten er enda mer, for selv om den har samme grad av substitusjon, er gruppene til gruppene3 av dobbeltbindingen er i transposisjoner, det vil si på forskjellige sider av dobbeltbindingen. Legg merke til at varmen til trans-2-buten (2707 kJ/mol) knapt er litt lavere enn for CIS-2-buten (2710 kJ/mol).
Den siste isomeren, 2-metyl-2-buten, som også er like erstattet som CIS og Trans 2 Bungeo, er likevel den mest ustabile av alle. Dette er fordi begge ch3 De finnes i en av karbonene i dobbeltbindingen, og er derfor en alken med CHO3 Geminal.
Karbonylforbindelser
I tillegg til alkoer og andre hydrokarboner generelt, er den relative stabiliteten til karbonylforbindelsene (ketoner, aldehyder, karboksylsyrer) også relatert til deres forbrenningsvarmer.
Dermed, jo mer stabiliserte, eller mindre reaktive gruppene C = O, vil mindreårige være deres forbrenningsvarmer.
For eksempel forbrenningsvarmen til butanalen, CH3Ch2Ch2Cho, det er 2475 kJ/mol. Denne varmen er høyere enn 2-butanon, CH3Ch2Coch3, som er lik 2442 kJ/mol. Derfor er butanal mer ustabil enn 2-butanon.
I 2-butanon er C = O mer stabilisert takket være gruppene CH3Ch2 og Ch3; Ting som ikke skjer med Butan, der en av gruppene knapt er et atom h.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Forbrenningsvarme. Hentet fra: i.Wikipedia.org
- CK-12 Foundation. Forbrenningsvarme. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- BBC. (2020). Kjemisk energi: entalpi av forbrenning. Hentet fra: BBC.co.Storbritannia
- Steven a. Hardinger. (2017). Illustrert ordliste over organisk kjemi: Forbrenningens entalpi. Gjenopprettet fra: Chem.UCLA.Edu

