Endringer av tilstandstyper og deres egenskaper (med eksempler)
- 3725
- 902
- Daniel Skuterud
De tilstand endringer eller fase er et termodynamisk fenomen der materien opplever reversible fysiske endringer. Det sies at det er termodynamisk fordi en varmeoverføring oppstår mellom materie og omgivelser; Eller hva som er det samme, det er interaksjoner mellom materie og energi som induserer en omorganisering av partikler.
Partiklene som opplever statusendringen forblir de samme før og etter det samme. Trykket og temperaturen er viktige variabler i hvordan disse blir plassert i en eller annen fase. Når en tilstandsendring oppstår, dannes et bifasisk system, bestående av samme sak i to forskjellige fysiske tilstander.
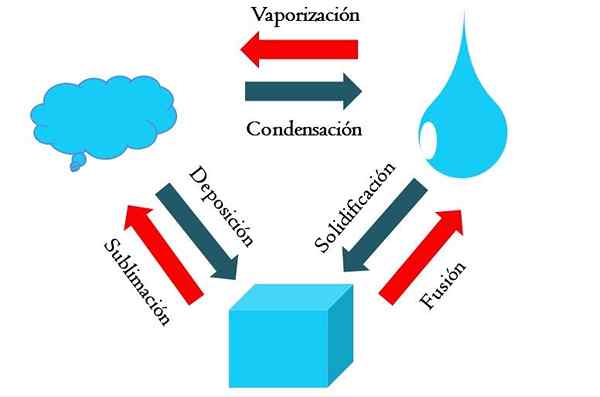
 Tilstand endringer. Kilde: Gabriel Bolívar
Tilstand endringer. Kilde: Gabriel Bolívar Det høyere bildet viser de viktigste tilstandsendringene som saken opplever under normale forhold.
En fast kube av et blåaktig stoff kan bli flytende eller gassformig avhengig av temperaturen og trykket i omgivelsene. I seg selv representerer det en enkelt fase: det faste stoffet. Men på smeltingstidspunktet, det vil si smelte, en solid-væske-balanse som kalles fusjon (rød pil mellom bøtta og den blå dråpen er etablert).
For å få fusjonen oppstått, må kuben absorbere varme fra omgivelsene for å øke temperaturen; Derfor er det en endotermisk prosess. Når kuben er smeltet, er den nok en gang en enkelt fase: den fra flytende tilstand.
Denne blota kan fortsette å absorbere varme, noe som øker temperaturen og gir opphav til dannelse av gassformige bobler. Igjen, det er to faser: den ene væsken og den andre brus. Når all væsken har fordampet gjennom kokepunktet, sies det da at den har kokt eller fordampet.
Nå ble blålige dråper forvandlet til skyer. Så langt har alle prosesser vært endotermiske. Blå gass kan fortsette å absorbere varme til den er oppvarmet; Imidlertid, gitt de terrestriske forholdene, har dette tvert imot en tendens til å avkjøle og kondensere igjen i væsken (kondens).
På den annen side kan skyer også avsettes direkte i en solid fase, og danner den faste kuben igjen (avsetning). Disse to siste prosessene er eksotermiske (blå piler); det vil si at de slipper varme til miljøet eller rundt.
I tillegg til kondens og avsetning, er det en tilstandsendring når blota fryser ved lave temperaturer (størkning).
[TOC]
Typer av tilstandsendringer og deres egenskaper
Bildet viser de typiske endringene for de tre (vanligste) tilstandene av materie: fast, flytende og gassformig. Endringene ledsaget av de røde pilene er endotermiske, de innebærer varmeabsorpsjon; Mens de ledsaget av blå piler er eksotermiske.
En kort beskrivelse av hver av disse endringene vil bli gjort nedenfor, og fremhever noen av dens egenskaper fra en molekylær og termodynamisk resonnement.
- Fusjon
Fusjon er endringen av tilstanden til et stoff fra fast tilstand til væsken.

I fast tilstand (ioner, molekyler, klynger osv.) er "fanger", som ligger i faste romposisjoner uten å kunne bevege seg fritt. Imidlertid er de i stand til å vibrere ved forskjellige frekvenser, og hvis disse er veldig sterke, vil den strenge orden pålagt av intermolekylære krefter begynne å "smuldre.
Som et resultat oppnås to faser: en der partiklene fortsetter innesperret (fast), og en annen der de er friere (væske), nok til å øke avstandene som skiller dem fra hverandre. For å oppnå dette må det faste stoffet absorbere varme, og dermed vil dets partikler vibrere med større kraft.
Det kan tjene deg: Atommasse: Definisjon, typer, hvordan du beregner det, eksemplerAv denne grunn er fusjonen endoterm, og når den begynner, sies det at en balanse mellom fast-væskefasene oppstår.
Varmen som er nødvendig for å gi opphav til denne endringen kalles varme eller smeltende entalpi (ΔHFus). Dette uttrykker mengden varme (energi, i KJ -enheter hovedsakelig) som må absorbere en mol faststoffstoff for å smelte, og ikke bare øke temperaturen.
Snøball
 Smeltende snø med hånden. Kilde: Pixabay
Smeltende snø med hånden. Kilde: Pixabay Med dette i bakhodet er det forstått hvorfor en snøball smelter i hånden (overlegen bilde). Snø absorberer kroppsvarme, som er nok til å heve temperaturen på snøen over 0 ° C.
Iskrystallene som er til stede i snøen absorberer riktig varme for å smelte, og slik at vannmolekylene deres tar i bruk en mer uordnet struktur. Mens snøen smelter, vil det dannede vannet ikke øke temperaturen, siden all håndvarmen drar nytte av snøen for å fullføre fusjonen.
- Fordampning

Fordampning er tilstanden til et stoff fra flytende tilstand til gassformig.
Fortsetter med eksemplet på vannet, som nå plasserer en håndfull snø i en gryte og lyser bålet, observeres det at snøen raskt smelter. Når vann blir oppvarmet, begynner små karbondioksidbobler og andre mulige gassforurensninger å danne seg.
 Kokende vann. Kilde: Pixabay
Kokende vann. Kilde: Pixabay Varmen utvidet molekylært de uordnede konfigurasjonene av vannet, utvider volumet og øker damptrykket; Derfor er det flere molekyler som unnslipper overflateproduktet av å øke fordampningen.
Flytende vann øker temperaturen sakte, på grunn av sin høye spesifikke varme (4 184J/° C ∙ g) g). Det er et punkt der varmen som absorberer ikke lenger bruker den for å heve temperaturen, men for å begynne væskedampbalansen; Det vil si at det begynner å koke og all væske vil passere til gassformig tilstand mens du absorberer varmen og holder temperaturen konstant.
Det er her intens boble observeres på overflaten av kokt vann (overlegen bilde). Varmen som absorberer flytende vann slik at damptrykket til dets begynnende bobler tilsvarer ytre trykk, kalles fordampning entalpi (ΔHVap).
Pressens rolle
Presset er også avgjørende i tilstandsendringer. Hva er dens effekt på fordampning? At ved større trykk, desto større er varmen som må absorbere vann for å koke, og derfor fordampes den over 100 ° C.
Dette er fordi økningen i trykk gjør det vanskelig å rømme fra vannmolekyler fra væskefasen til brus.
Trykkpotter bruker dette faktum i deres favør for å varme opp mat i vann ved en temperatur over kokepunktet.
På den annen side, med et vakuum eller reduksjon i trykk, trenger flytende vann en lavere temperatur for å koke og gå videre til gassfasen. Med mye eller lite trykk, må vannet å absorbere dens respektive fordampningsvarme for å fullføre statens endring av staten.
- Kondensasjon
Kondensering er tilstanden til et stoff fra gassformig tilstand til flytende tilstand.
Kan tjene deg: galaktose
Vann har fordampet. Hva blir det neste? Vanndamp kan fremdeles øke temperaturen og bli en farlig strøm som kan forårsake alvorlige forbrenninger.
Anta imidlertid i stedet at det avkjøles. Som? Slipper varme til miljøet, og når det frigjøres, sies det at en eksotermisk prosess skjer.
Ved å frigjøre varmen begynner de veldig energi -gassformige molekylene å bremse ned. Også interaksjonene begynner å være mer effektive etter hvert som damptemperaturen går ned. For det første vil vanndråper, dampkondensat, etterfulgt av større dråper som ender opp med å bli tiltrukket av tyngdekraften, bli dannet.
For å kondensere en viss mengde damp, må du frigjøre den samme energien, men med et motsatt tegn, på ΔHVap; det vil si dens kondens entalpi ΔHCond. Dermed er den motsatte, damp-væskebalansen stabil.
Fuktede vinduer
 Vannkondensasjon. Kilde: Pexels
Vannkondensasjon. Kilde: Pexels Kondens kan observeres i husholdningsvinduer selv. I et kaldt vær kolliderer vanndampen inne i huset med vinduet, som med sitt materiale har lavere temperatur enn andre overflater.
Der er det lettere for dampmolekyler å gruppere, og skaper et tynt hvitaktig lag som lett kan flyttes for hånd. Ettersom disse molekylene frigjør varme (oppvarming av glass og luft), begynner de å danne flere klynger til de kan kondensere de første dråpene (øvre bilde).
Når dråpene øker størrelsen kraftig, glir de gjennom vinduet og etterlater et vannspor.
- Størkning
Størkning er tilstanden til et stoff fra flytende tilstand til fast tilstand.

Størkning oppstår på grunn av kjøling; Med andre ord, vann fryser. For å fryse, må vannet frigjøre den samme mengden varme som absorberer is for å smelte. Igjen kalles denne varmen størkning eller frysende entalpi, ΔHCong (-ΔHFus).
Når avkjøling mister vannmolekyler energi og deres intermolekylære interaksjoner blir sterkere og mer retningsbestemt. Som et resultat blir de bestilt takket være hydrogenbroene sine og danner de så -kallede iskrystaller. Mekanismen som iskrystaller får innvirkning på utseendet deres: gjennomsiktig eller hvit.
 Isskulptur. Kilde: Pixabay
Isskulptur. Kilde: Pixabay Hvis iskrystaller vokser veldig sakte, okkluderer ikke disse urenheter, for eksempel gasser som ved lave temperaturer er solubilisert i vann. Dermed slipper bobler og kan ikke samhandle med lys; Og følgelig er det en is som er så gjennomsiktig som for en ekstraordinær isstatue (overlegen bilde).
Det samme som skjer med is, kan skje med ethvert annet stoff som stivner ved avkjøling. Kanskje dette er den mest komplekse fysiske endringen i terrestriske forhold, siden flere polymorfer kan oppnås.
- Sublimering
Sublimering er tilstanden til et stoff fra det faste stoffet til gassen.

Kan vann sublim? Nei, i det minste ikke under normale forhold (t = 25 ° C, p = 1 atm). For sublimering oppstår, det vil si endring av gass fast tilstand, må damptrykket til det faste stoffet være høyt.
På samme måte er det viktig at deres intermolekylære krefter ikke er veldig sterke, helst hvis de bare består av spredningskrefter
Det mest emblematiske eksemplet er solid jod. Det er et krystallinsk faststoff av grå-morale toner, som har høyt damptrykk. Slik er slik at i sin handling følger en lilla damp, hvis volum og utvidelse er bemerkelsesverdig når han er under oppvarming.
Kan tjene deg: Triethilamine: Struktur, egenskaper, bruksområder og risikoer Sublimering av jod. Kilde: Belkina N V [CC av 4.0 (https: // creativecommons.Org/lisenser/av/4.0)], fra Wikimedia Commons
Sublimering av jod. Kilde: Belkina N V [CC av 4.0 (https: // creativecommons.Org/lisenser/av/4.0)], fra Wikimedia Commons I det øvre bildet vises et typisk eksperiment der fast jod fordamper i en glassbeholder. Det er interessant og påfallende å observere hvordan lilla damper formidles, og den initierte studenten kan bekrefte fraværet av flytende jod.
Dette er hovedkarakteristikken ved sublimering: det er ingen tilstedeværelse av en flytende fase. Det er også endotermisk, siden det faste stoffet absorberer varmen for å øke damptrykket til å være lik ytre trykk.
- Avsetning
 Iodo Crystal Depposition. Kilde: Stanislav.Nevyhosteny [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons
Iodo Crystal Depposition. Kilde: Stanislav.Nevyhosteny [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons Avsetningen er tilstanden til et stoff fra gassformig tilstand til fast tilstand.
Parallelt med jod -sublimeringseksperimentet, har du avsetningen som. Avsetning er den motsatte endringen eller overgangen: Stoffet passerer fra gassformens tilstand til det faste stoffet uten dannelse av en flytende fase.
Når jod lilla damper kommer i kontakt med en kald overflate, slipper de varme for å varme den opp, mister energi og omgrupperer molekylene sine igjen i det grå-gjørmete faste stoffet (overlegen bilde). Det er da en eksotermisk prosess.
Avsetningen er mye brukt for syntese av materialer der de doping med metallatomer gjennom sofistikerte teknikker. Hvis overflaten er veldig kald, er varmeutvekslingen mellom den og damppartiklene brå, og utelater passasjen gjennom den respektive væskefasen.
Varmen eller entalpien av avsetning (og ikke Avsetning) er sublimering (ΔhUnder=- ΔHD.E.P). I teorien kan mange stoffer sublimeres, men for å oppnå dette er det nødvendig å manipulere trykk og temperaturer, i tillegg til å ha sitt P vs t -diagram for hånden; der deres fjerne mulige faser kan visualiseres.
Andre statsendringer
Selv om de ikke er nevnt, er det andre stater av materie. Noen ganger er de preget av å ha "litt av hver", og derfor en kombinasjon av dem. For å generere dem, bør trykk og temperaturer manipuleres til veldig positive (store) eller negative (små) størrelser.
For eksempel, hvis gassene blir varmt oppvarmet, vil de miste elektronene og deres positivt belastede kjerner i det negative tidevannet vil utgjøre det som kalles plasma. Det er synonym for "elektrisk gass", siden den presenterer høy elektrisk ledningsevne.
På den annen side, når temperaturene går ned for mye, kan materie oppføre seg intetanende; Det vil si at de viser unike egenskaper rundt absolutt null (0 k).
En av disse egenskapene er overflødighet og superledelse; så vel som dannelsen av Bose-Einstein kondensat, der alle atomer oppfører seg som en.
Selv noen undersøkelser peker på fotonisk materiale. I dem er partiklene av elektromagnetisk stråling, fotonene, gruppert for å danne fotoniske molekyler. Det vil si at det vil gi masse til noen lys av lys, teoretisk.
Referanser
- Helmestine, Anne Marie, PH.D. (19. november 2018). Liste over faseendringer mellom tilstanden av materie. Gjenopprettet fra: Thoughtco.com
- Wikipedia. (2019). Når det gjelder. Hentet fra: i.Wikipedia.org
- Dorling Kindersley. (2007). Skiftende tilstand. Gjenopprettet fra: factmonster.com
- Meyers ami. (2019). Faseendring: fordamping, kondens, frezing, smelting, sublimering og deponering. Studere. Gjenopprettet fra: Studie.com
- Bagley m. (11. april 2016). Matter: Definisjon og de fem tilstandene av materie. Gjenopprettet fra: Livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- « Andre lov om termodynamikkformler, ligninger, eksempler
- Kaliumjodid (ki) struktur, egenskaper, innhenting, bruk, risiko »

