Valencia Layer
- 996
- 183
- Prof. Theodor Gran
 Valencia -laget er der kjemiske reaksjoner oppstår
Valencia -laget er der kjemiske reaksjoner oppstår Hva er Valencia -laget?
De Valencia Layer Det er at hvis elektroner er ansvarlige for de kjemiske egenskapene til et element. Elektronene i dette laget samhandler med de av et nabomat, for å danne kovalente bindinger (A-B); Og hvis de emigrerer fra ett atom til et annet mer elektronegativ, ioniske koblinger (A+B-).
Dette laget er definert av hovedkvantetallet n, som igjen indikerer perioden der elementet er plassert i det periodiske tabellen. Mens bestillingen av grupper er avhengig av antall elektroner som går i bane i Valencia -laget.
Slik at for en n Lik 2, kan du okkupere åtte elektroner: åtte grupper (1-8).
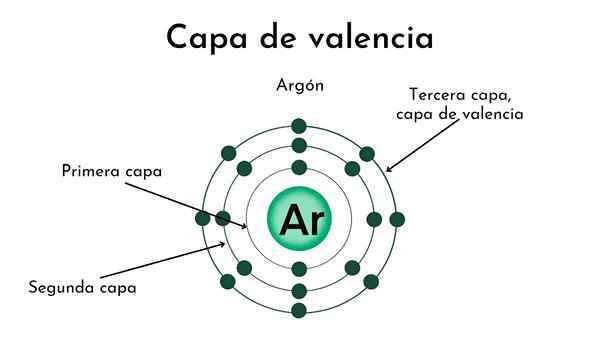
 Kjerne av et atom med fire lag. Kilde: Gabriel Bolívar
Kjerne av et atom med fire lag. Kilde: Gabriel Bolívar I det øvre bildet og dekselet er betydningen av Valencia -laget illustrert. Det svarte punktet i midten av atomet er kjernen, mens de gjenværende konsentriske sirklene er de elektroniske lagene definert av n.
Hvor mange lag har dette atomet? Hver av dem har sin egen farge, og når det er fire, har atomet fire lag (n= 4).
Legg merke til at fargen er nedverdigende når avstanden fra laget øker til kjernen. Valencia -laget er det som er lenger borte fra kjernen: den klareste fargen.
Hva er Valencia -laget?
I følge bildet er Valencia -laget ikke annet enn de siste orbitalene til et atom okkupert av elektroner. I det lyseblå laget, for n= 4 Det er en serie på 4S, 4P, 4D og 4F orbitaler; Det vil si at det er andre under -leder med forskjellige elektroniske evner.
Et atom trenger elektroner for å fylle alle 4N -orbitaler. Denne prosessen kan observeres i de elektroniske konfigurasjonene av elementene over en periode.
Kan tjene deg: lineære alkaner: struktur, egenskaper, nomenklatur, eksemplerFor eksempel har kalium elektronisk konfigurasjon [AR] 4S1, Mens kalsium, til høyre for deg, [ar] 4s2.
I henhold til disse konfigurasjonene, hva er Valencia -laget? Begrepet [AR] refererer til den elektroniske konfigurasjonen av edel argon 1s gass22s22 s63s23p6. Dette representerer det indre eller lukkede laget (som også er kjent som Kjerne).
Siden 4S -orbitalen er den med den største energien, og hvor de nye elektronene kommer inn, representerer den valenslaget for både K og CA. Hvis atomene til K og Ca ble sammenlignet med bildet, ville [AR] være alle de indre lagene av blått; og 4S det lyseblå laget, det ytre.
Valencia Layer -egenskaper
Fra det ovennevnte kan noen egenskaper ved Valencia -laget oppsummeres for alle atomer:
-Energinivået er høyere; Hva som er det samme, trekkes mer ut av kjernen og har den laveste elektroniske tettheten (sammenlignet med andre lag).
-Det er ufullstendig. Derfor vil det fortsette å være fylt med elektroner som en periode fra venstre til høyre reiser i det periodiske bordet.
-Griper inn i dannelsen av kovalente eller ioniske koblinger.
Når det gjelder kalium- og kalsiummetaller, oksiderer de for å transformere seg til kationer. K+ Den har elektronisk konfigurasjon [AR], fordi den mister sin eneste 4S eksterne elektron1. Og på siden av CA2+, Konfigurasjonen er også [AR]; For i stedet for å miste et elektron, mister det to (4s2).
Men hva er forskjellen mellom k+ og Ca2+, Hvis begge mister elektronene i valenslaget og har elektronisk konfigurasjon [AR]? Forskjellen er i sine ioniske radioer.
Kan tjene deg: Merkur Oxide (HG2O)Ac2+ er mindre enn k+ Fordi kalsiumatomet har en ekstra proton som tiltrekker eksterne elektroner (lukket eller Valencia) mer kraft).
Valencia 4S -laget har ikke forsvunnet: det er bare tomt for disse ionene.
Valencia Layer eksempler
Konseptet med Valencia -lag kan være direkte eller indirekte i mange aspekter av kjemi.
Fordi elektronene deres er de som deltar i dannelsen av bindinger, ethvert emne som adresserer dem (TEV, RPECV, reaksjonsmekanismer, etc.) Du må henvise til nevnte lag.
Dette er fordi de, viktigere enn valenslaget, er dets elektroner, kalt Valencia -elektroner. Når de representerer den progressive konstruksjonen av elektroniske konfigurasjoner, definerer de atomets elektroniske struktur, og derfor dens kjemiske egenskaper.
Fra denne informasjonen fra ett atom a og et annet B, kan strukturene til forbindelsene deres støttes gjennom Lewis strukturer. På samme måte kan de elektroniske og molekylære strukturene til en rekke forbindelser bestemmes takket være antall valenselektroner.
De mulige og enkleste eksemplene på valenslag er i den periodiske tabellen; Spesielt i elektroniske konfigurasjoner.
Eksempel 1
Det er mulig å identifisere et element og dets beliggenhet i den periodiske tabellen bare med elektronisk konfigurasjon. Således, hvis et element X har konfigurasjon [KR] 5s25 s1, Hva handler det om og hvilken periode og gruppe hører hjemme?
Gitt n= 5, x er i femte periode. I tillegg har den tre elektroner av Valencia: to i 5s orbital2 Og en i 5p1. Det indre laget [KR] gir ikke mer informasjon.
Det kan tjene deg: Bromhydronsyre (HBR)Ettersom X har tre elektroner, og dens 5p -orbitaler er ufullstendige, er den i blokk P; Dessuten i gruppe IIIA (Romanesque) eller 13 (nåværende nummereringssystem av IUPAC). X er da det indiske elementet, i.
Eksempel 2
Hva er X -elementet med elektronisk konfigurasjon [KR] 4D105s1? Legg merke til at det som i, det hører til periode 5, siden 5s orbital1 er mest energi. Valencia -laget inkluderer imidlertid også 4D -orbitaler, siden de er ufullstendig.
Valencia -lag kan deretter betegnes som NSNP, for et element i P- eller S -blokken; eller (n-1) DNS, for et element av blokk D. Slik at det mystiske elementet X tilhører blokk D fordi dens elektroniske konfigurasjon er av typen (N-1) DNS (4D105s1).
Hvilken gruppe tilhører? Legge til de ti elektronene i 4D -orbitalen10, og en av 5s1, X har elleve elektroner fra Valencia. Derfor må det være lokalisert i gruppe IB u 11. Så reiser du gjennom periode 5 av det periodiske bordet til gruppe 11 når du kommer til sølvelementet, AG.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi (fjerde utgave, p. 23). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Kjemi (8. utg.). Cengage Learning, P. 287.
- NDT Resource Center (S.F.). Valensskallet. Hentet fra: nde-ed.org
- Clackamas Community College (2002). Valenselektroner. Hentet fra: DL.Clackamas.Edu
- Kjemi librettexts (s.F.). Valens og kjerneelektroner. Gjenopprettet fra: Chem.Librettexts.org

