Ammoniumkarbonat ((NH4) 2CO3)
- 4909
- 841
- Prof. Oskar Aas
Hva er ammoniumkarbonat?
Han Ammoniumkarbonat Det er et uorganisk nitrogensalt, spesielt ammoniakal, hvis kjemiske formel er (NH4)2Co3. Det blir utdypet ved syntesemetoder, blant dem det er verdt å bruke sublimering av en blanding av ammoniumsulfat og kalsiumkarbonat: (NH4)2SW4(S)+ Caco3(S) => (NH4)2Co3(S)+ sak4(S).
Generelt blir ammoniumsalter og kalsiumkarbonat oppvarmet i en beholder for å forårsake ammoniumkarbonat. Den industrielle metoden som produserer tonn av dette saltet er å passere karbondioksid gjennom en absorpsjonskolonne som inneholder en løsning av ammonium i vann, og deretter utføre en destillasjon.
Dampene som inneholder ammonium, karbondioksid og vann blir kondensert for å danne ammoniumkarbonatkrystaller: 2NH3(g)+ h2Eller (l) + co2(g) → (NH4)2Co3(S). I reaksjonen oppstår karbonsyre, h2Co3, Etter å ha oppløst karbondioksid i vannet, og det er denne syren som gir sine to protoner, h+, til to ammoniakkmolekyler.
Ammoniumkarbonategenskaper
 Utseende av ammoniumkarbonat
Utseende av ammoniumkarbonat Det er et hvitt, krystallinsk og fargeløst fast stoff, med sterke lukter og ammoniakksmaker. Smelter til 58 °.
Imidlertid forekommer denne nedbrytningen i to trinn: Først frigjøres et NH -molekyl3, Produserer ammoniumbikarbonat (NH4HCO3); Og for det andre, hvis oppvarmingen fortsetter, er karbonat uforholdsmessig.
Det er en fast oppløselig i vann og mindre oppløselig i alkoholer. Form hydrogenbroer med vann, og når 5 gram oppløses i 100 gram vann, genererer det en grunnleggende løsning med en pH rundt 8,6.
Kan tjene deg: Emulgator: Emulsjonsprosess, molekylære aspekter, applikasjonerDen høye affiniteten til vann er laget av et hygroskopisk fast stoff (det absorberer fuktighet), og det er derfor det er vanskelig å finne det i sin anhydridform. Faktisk dens monohydratform, (NH4)2Co3· H2O), er den vanligste av alle og forklarer hvordan salt er en bærer av ammoniakkgass, og forårsaker lukt.
I luften bryter det ned for å generere ammoniumbikarbonat og ammoniumkarbonat (NH4NH2Co2).
Kjemisk struktur
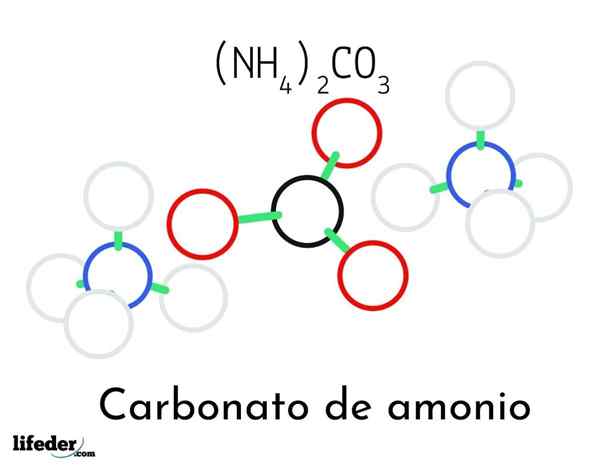
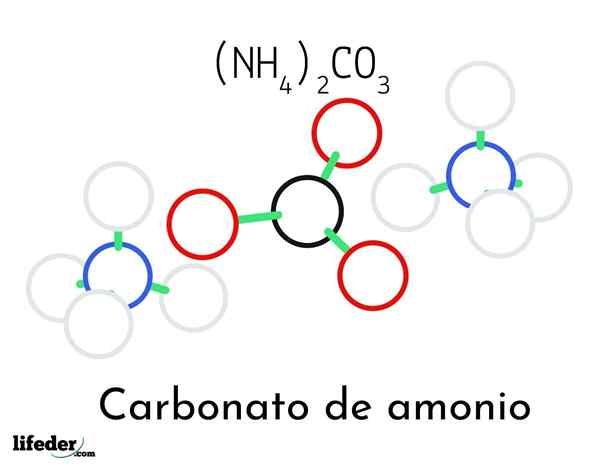
 Ammoniumkarbonatstrukturmodell; To ammonium og ett karbonatkationer
Ammoniumkarbonatstrukturmodell; To ammonium og ett karbonatkationer I det overordnede bildet illustreres den kjemiske strukturen til ammoniumkarbonat. I midten er anion co32-, den flate trekanten med det svarte senteret og de røde kulene; Og til sine to sider, ammonios NH -kationer4+ med tetraedriske geometrier.
Ammoniumiongeometrien forklares med SP -hybridisering3 av nitrogenatom, bestiller hydrogenatomer (de hvite kulene) rundt det i form av en tetrahedron. Blant de tre ionene er etablert av hydrogenbroer (h3N-H- O-CO22-).
Takket være geometrien, en enkelt co -anion32- kan danne seg opptil tre hydrogenbroer; Mens NH -kationer4+ Kanskje de ikke kan danne sine tilsvarende fire hydrogenbroer på grunn av de elektrostatiske frastøttene blant deres positive ladninger.
Resultatet av alle disse interaksjonene er krystalliseringen av et ortorrombisk system. Hvorfor er det så hygroskopisk og vannløselig? Svaret er i samme forrige avsnitt: Hydrogenbroer.
Disse interaksjonene er ansvarlige for den raske vannabsorpsjonen av anhydrid salt for å danne (NH4)2Co3· H2ENTEN). Dette resulterer i endringer i den romlige arrangementet av ionene, og derfor i den krystallinske strukturen.
Det kan tjene deg: Nikkelklorid (NICL2): Struktur, egenskaper, innhenting, brukStrukturelle nysgjerrigheter
Uansett hvor enkel (NH ser ut4)2Co3, Det er så følsomt for utallige transformasjoner at dens struktur er et mysterium som er sendt til den sanne sammensetningen av det faste stoffet. Denne strukturen varierer også i henhold til trykket som påvirker krystallene.
Noen forfattere har funnet at ioner er bestilt som koplaner foret av hydrogenbroer (det vil si en kjede med en NH -sekvens4+-Co32--...) der vannmolekyler sannsynligvis fungerer som kontakter til andre kjeder.
Enda mer, overskrider den terrestriske himmelen, hvordan er disse krystaller under romlige eller interstellare forhold? Hva er komposisjonene dine når det gjelder stabiliteten til kullsyreholdige arter? Det er studier som bekrefter den store stabiliteten til disse krystallene fanget i planetariske og kometer ismasser.
Dette gjør at de kan tjene som karbon-, nitrogen- og hydrogenreserver, som mottar solstråling, kan transformeres til organisk materiale som aminosyrer.
Det vil si at disse iskremen ammoniakksblokker kan være bærere av "The Wheel som starter Machinery of Life" i kosmos. Av disse grunner øker interessen deres for astrobiologi og biokjemi.
Bruk/applikasjoner
Det brukes som leuer, siden det å bli oppvarmet produserer karbondioksid og ammoniumgasser. Ammoniumkarbonat er, hvis du vil, en forløper for moderne bakepulver og kan brukes til å bake kaker og flate kjeks.
Imidlertid anbefales det ikke å bake kaker. På grunn av tykkelsen på kakene, beholdes ammoniumgassene inni og gir en ubehagelig smak.
Det kan tjene deg: Cyclohexen: Struktur, egenskaper, syntese og brukDet brukes som en slimløsende, det vil si lindrer hoste når du avgir bronkiene. Den har soppmiddelaksjon, bruker av denne grunn i landbruket. Det er også en regulator for surheten som er til stede i mat og brukes i organisk ureasyntese i høyt trykk, og hidantoinas.
Risiko
Ammoniumkarbonat er svært giftig. Det produserer hos mennesker en akutt irritasjon av munnhulen når du tar kontakt.
I tillegg, hvis inntatt forårsaker gastrisk irritasjon. En lignende handling blir observert i øynene utsatt for ammoniumkarbonat.
Innånding av salt nedbrytningsgasser, kan irritere nesen, halsen og lungene og forårsake hoste og luftveisnød.
Akutt hundeeksponering på ammonat ammonat i en dose på 40 mg/kg vekt, forårsaker oppkast og diaré. De høyeste dosene ammoniumkarbonat (200 mg/kg vekt) er vanligvis dødelige. Hjerteskade er indikert som dødsårsaken.
Hvis den varmes opp ved veldig høye temperaturer og i en luft beriket med oksygen, gir den giftige gasser2.
Referanser
- Pubchem. (2018). Ammoniumkarbonat. Hentet 25. mars 2018 fra Pubchem: Pubchem.NCBI.NLM.NIH.Gov
- Organisk kjemiportal. ((2009-2018))). Bucherer-Bergs reaksjon. Hentet 25. mars 2018, fra Organic Chemistry Portal: www.Organisk kjemi.org
- Wikipedia. (2018). Ammoniumkarbonat. Hentet 25. mars 2018, fra Wikipedia: i.Wikipedia.org
- Det kjemiske selskapet. (2018). Det kjemiske selskapet. Hentet 25. mars 2018 fra The Chemical Company: TheChemco.com