Kalsiumkarbid (CAC2) struktur, egenskaper, innhenting, bruk

- 4653
- 1420
- Daniel Skuterud
Han Kalsiumkarbid Det er en uorganisk forbindelse dannet av kalsium (CA) og karbon (C) elementer (C). Den kjemiske formelen er CAC2. Det er et fast stoff som kan være fargeløs for gulaktig eller gråaktig hvit, og til og med svart avhengig av urenheter den inneholder.
En av hans viktigste kjemiske reaksjoner av CAC2 er den som oppstår med vann h2Eller, der HC≡CH acetylenform. Derfor brukes den til å oppnå acetylen industrielt. På grunn av den samme vannreaksjonen brukes til å modne frukt, i falske kanoner og i marine fakler.
 CAC kalsiumkarbid2 fast. Ondřej Mangl / Pub Domain. Kilde: Wikimedia Commons.
CAC kalsiumkarbid2 fast. Ondřej Mangl / Pub Domain. Kilde: Wikimedia Commons. Reaksjonen fra CAC2 Med vann produserer også en nyttig gjørme for å fremstille kløker (en sementkomponent), som produserer mindre karbondioksid (CO2) Hvis sammenlignet med den tradisjonelle metoden for å produsere sement.
Med nitrogen (n2) Kalsiumkarbid danner cyanamid av kalsium, som brukes som gjødsel. CAC2 Det brukes også til å fjerne svovel fra visse metalllegeringer.
For en tid tilbake CAC2 Den ble brukt i de så kalt karbidlamper, men disse er ikke lenger veldig vanlige fordi de er farlige.
[TOC]
Struktur
Kalsiumkarbid er en ionisk forbindelse og dannes av Ca Calcio -ionet2+ og karbid eller acetyluro c C22-. Karbidionet består av to karbonatomer forenet med en trippelbinding.
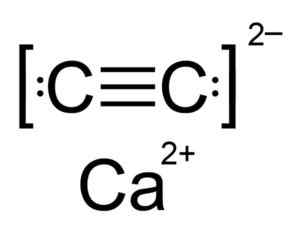 Kjemisk struktur av kalsiumkarbid. Forfatter: Hellbus. Kilde: Wikimedia Commons.
Kjemisk struktur av kalsiumkarbid. Forfatter: Hellbus. Kilde: Wikimedia Commons. Den krystallinske strukturen til CAC2 Det er avledet fra kubikk (for eksempel natriumklorid NaCl), men som ion C22- Strukturen er langstrakt er forvrengt og blir tetragonal.
Nomenklatur
- Kalsiumkarbid
- Kalsiumkarbid
- Kalsiumacetylure
Egenskaper
Fysisk tilstand
Krystallinsk faststoff som når det er rent, men hvis det er forurenset med andre forbindelser, kan det være gulaktig eller gråaktig til svart.
 CAC kalsiumkarbid2 Med urenheter. Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
CAC kalsiumkarbid2 Med urenheter. Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Molekylær vekt
64.0992 g/mol
Det kan tjene deg: Alilo: Allyic Unit, Carbocation, Radical, EksemplerSmeltepunkt
2160 ºC
Kokepunkt
CAC2 koker ved 2300 ºC med nedbrytning. Kokepunktet skal måles under inert atmosfære, det vil si uten oksygen eller fuktighet.
Tetthet
2,22 g/cm3
Kjemiske egenskaper
Kalsiumkarbid reagerer med vann for å danne HC≡CH acetylen og Ca kalsiumhydroksyd (OH)2:
CAC2 + 2 h2O → HC≡CH + Ca (OH)2
Acetylen er brannfarlig, derfor i nærvær av fuktighet CAC2 Det kan være brennbar. Når det er tørt, er det imidlertid ikke.
 CAC kalsiumkarbid2 Med vann HC≡CH acetylenform, brennbar forbindelse. Kristina Kravets/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
CAC kalsiumkarbid2 Med vann HC≡CH acetylenform, brennbar forbindelse. Kristina Kravets/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Kalsiumkarbid reagerer med nitrogen N2 Å danne CACN Calcio cyanamid2:
CAC2 + N2 → CACN2 + C
Å skaffe
Kalsiumkarbid produseres industrielt i en elektrisk bueovn basert på en blanding av kalsiumkarbonat (Caco3) og kull (c) som sendes inn ved en temperatur på 2000 ° C. Reaksjonen er oppsummert som følger:
Tyv3 + 3 C → CAC2 + Co ↑ + co2↑
Eller også:
CAO + 3 C → CAC2 + CO ↑
I en elektrisk bueovn er det en strømbue mellom to grafittelektroder, som motstår de høye temperaturene som dannes. Et kalsiumkarbid med 80-85% renhet oppnås.
applikasjoner
I acetylenproduksjon
Industrielt brukes kalsiumkarbidreaksjon med vann for å produsere acetylen C2H2.
CAC2 + 2 h2O → HC≡CH + Ca (OH)2
Dette er den viktigste bruken av kalsiumkarbid. I noen land blir acetylen høyt verdsatt, siden det tillater å produsere polyvinylklorid, som er en type plast. I tillegg tjener acetylen til å utføre sveiser ved høye temperaturer.
 HC≡CH acetylen flammemetaller ved veldig høye temperaturer. Forfatter: Shutterbug75. Kilde: Pixabay.
HC≡CH acetylen flammemetaller ved veldig høye temperaturer. Forfatter: Shutterbug75. Kilde: Pixabay. For å redusere CO -utslipp2
Restene oppnådd fra å oppnå acetylen fra CAC2 (Også kalt "kalsiumkarbidslam" eller "kalsiumkarbidrester") De tjener til å brukes til å oppnå kløker eller betong.
Kan tjene deg: Teknologiske anvendelser av den elektroniske utslippet av atomerKalsiumkarbid gjørme har et høyt kalsiumhydroksydinnhold (CA (OH)2) (ca. 90%), noe kalsiumkarbonat (Caco3) og har en pH større enn 12.
 Kalsiumkarbidrester kan brukes i byggeaktiviteten for å fremstille betong, og dermed redusere generasjonen av CO2 av nevnte industri. Forfatter: Engin Akyurt. Kilde: Pixabay.
Kalsiumkarbidrester kan brukes i byggeaktiviteten for å fremstille betong, og dermed redusere generasjonen av CO2 av nevnte industri. Forfatter: Engin Akyurt. Kilde: Pixabay. Av disse grunner kan du reagere med Sio2 muntlig2ENTEN3 danner et produkt som ligner det som er oppnådd ved sementhydreringsprosessen.
En av de menneskelige aktivitetene som produserer mest samvær2 Det er byggebransjen. Co2 Det genereres øst for kalsiumkarbonat under reaksjonen for å danne betong.
Ved hjelp av kalsiumkarbid gjørme for å erstatte kalsiumkarbonat (Caco3) Det har blitt funnet at co -emisjoner er redusert2 I 39%.
Ved å få kalsiumcyanamid
Kalsiumkarbid brukes også industrielt for å oppnå kalsiumcyanamid CACN2.
CAC2 + N2 → CACN2 + C
Kalsiumcyanamid har brukt som gjødsel, fordi det med jordvann blir cyanamid H2N = C = N, som gir nitrogen til planter, et essensielt næringsstoff for disse.
I den metallurgiske industrien
Kalsiumkarbid brukes til å fjerne legeringer som Ferroníquel. CAC er blandet2 Med den smeltede legeringen ved 1550 ° C. Svovel (er) reagerer med kalsiumkarbid og kalsiumsulfid CAS og kull C:
CAC2 + S → 2 C + CAS
Svovelfjerning er foretrukket hvis blanding er effektivt og karboninnhold i legering er lavt. Casclium kalsiumsulfid flyter på overflaten av den smeltede legeringen der den velger og kastet.
I flere bruksområder
Kalsiumkarbid har blitt brukt ved eliminering av jernsvovel. Også som drivstoff i produksjonen av stål og som en kraftig deoksidant.
Kan tjene deg: aromatisk elektrofil substitusjon: mekanisme og eksemplerDet brukes til å modne frukt. Fra kalsiumkarbid med vann genereres acetylen, noe som induserer modning av frukt, for eksempel bananer.
 Bananer kan modnes ved hjelp av CAC -kalsiumkarbid2. Forfatter: Alexas Bilder. Kilde: Pixabay.
Bananer kan modnes ved hjelp av CAC -kalsiumkarbid2. Forfatter: Alexas Bilder. Kilde: Pixabay. Kalsiumkarbid brukes i falske kanoner for å forårsake den høye eksplosjonsstøyen som kjennetegner dem. Her brukes også acetylenformasjon, som eksploderer med en gnist i gjenstanden.
CAC2 Det brukes til å generere signaler på høye hav i marinefakkler som selv vurderer.
Avbryt bruk
CAC2 Det har blitt brukt i de så kalt karbidlamper. Driften av disse består i dryppende vann på kalsiumkarbid for å danne acetylen, som slås på og dermed gir lys.
Disse lampene ble brukt i kullgruver, men bruken deres ble avviklet på grunn av tilstedeværelsen av metangass Cho4 I disse gruvene. Denne gassen er brannfarlig og flammen på karbidampen kan få den til å skyte eller utnytte.
 CAC kalsiumkarbidlampe2. Scehardt / Pub Domain. Kilde: Wikimedia Commons.
CAC kalsiumkarbidlampe2. Scehardt / Pub Domain. Kilde: Wikimedia Commons. De ble mye brukt i skifer steingruver, kobber og tinn, og også i de første bilene, motorsykler og sykler, for eksempel frontlys eller frontlykter.
De er for øyeblikket erstattet av elektriske lamper eller til og med LED -lamper. Imidlertid brukes de fortsatt i land som Bolivia, i Potosí Silver Mines.
Risiko
CAC kalsiumkarbid2 tørr er ikke brannfarlig, men i nærvær av fuktighetsform acetylen, som er.
Å slukke en brann i nærvær av CAC2 Vann, skum, karbondioksid eller halogenslukningsapparater skal aldri brukes. Natrium eller kalsiumhydroksyd bør brukes.
Referanser
- Ropp, r.C. (2013). Gruppe 14 (C, Si, GE, SN og Pb) alkaliske jordforbindelser. Kalsiumkarbider. I leksikon av de alkaliske jordforbindelsene. Gjenopprettet fra Scientedirect.com.
- Pohanish, r. P. (2017). C. Karbidkalsium. I Sittigs håndbok med giftige og farlige kjemikalier og karsinagener (syvende utgave). Gjenopprettet fra Scientedirect.com.
- Sun, h. et al. (2015). Egenskaper til kjemisk kombinert kalsiumkarbid resue og dens inffeksjon på sementegenskaper. Materialer 2015, 8, 638-651. NCBI kom seg.NLM.NIH.Gov.
- Nie, Z. (2016). Øko-materialer og vurdering av livssyklus. Casestudie: CO2 Utslippsanalyse av kalsiumkarbid slamklinker. I grønn og bærekraftig produksjon av avansert materiale. Gjenopprettet fra Scientedirect.com.
- Crundwell, f.K. Et al. (2011). Raffinering av smeltet Ferronickel. Fjerning av svovel. I Extractive Metallurgy of Nickel, Cobalt og Platinum Group Metals. Gjenopprettet fra Scientedirect.com.
- Tressler, r.OG. (2001). Strukturell og termostrukturell keramikk. Karbider. I Encyclopedia of Materials Science and Technology. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.

