Katalaseegenskaper, struktur, funksjoner, patologier
- 2817
- 183
- Jonathan Carlsen
De katalase Det er et oksidoreduktase -enzym (H2O2: H2O2 oksidorreduktase) vidt distribuert i naturen. Katalyserer, i forskjellige vev og typer celler, "dekomponering" -reaksjonen av hydrogenperoksyd i molekylært oksygen og vann.
De første observasjonene av denne typen enzym dateres tilbake til begynnelsen av 1810 -tallet, men det var i 1901 da Loew anerkjente at katalase er tilnærmet til stede i alle eksisterende levende organismer og i flere typer forskjellige celler.
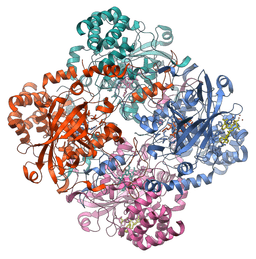
 Molekylær struktur i katalaseenzymet (kilde: Vossman [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons)
Molekylær struktur i katalaseenzymet (kilde: Vossman [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons) Dette enzymet, avgjørende for opprettholdelse av cellulær integritet og hovedregulator for hydrogenperoksydmetabolisme, var en grunnleggende faktor for å bekrefte at det i naturen er enzymer som virker på spesifikke underlag.
Pattedyr og andre organismer har katalasenzymer som også kan oppføre seg som peroksidaser, katalysere oksidasjonsreaksjoner av forskjellige underlag ved bruk av hydrogenperoksyd.
I de fleste eukaryoter er katalasenzymer overveiende i subcellulære organeller kjent som "peroksisomer", og hos mennesker er det mange patologiske forhold relatert til mangelen på dette enzymet.
[TOC]
Kjennetegn
Aktiviteten til enzymer som katalase kan variere betydelig avhengig av typen vev som vurderes. Hos pattedyr, for eksempel, er katalaseaktivitet betydelig både i nyrene og i leveren, og er mye lavere i bindevev.
Slik at katalase hos pattedyr hovedsakelig er assosiert med alle vev som har betydelig aerob metabolisme.
Pattedyr har katalas både i mitokondrier og i peroksisomer, og i begge rom er enzymer assosiert med organelemembraner. I erytrocytter, tvert imot, er katalaseaktivitet assosiert med et oppløselig enzym (husk at erytrocytter har knappe indre organeller).
Kan tjene deg: Half Stuart: Foundation, Preparation and UsesKatalase er et enzym med et høyt antall erstatning eller konstant katalytisk (det er veldig raskt og effektivt) og den generelle reaksjonen som katalyserer er som følger:
2H2O2 → 2H2O + O2
I nærvær av lave konsentrasjoner av hydrogenperoksyd, oppfører pattedyrkatalase for eksempel seg som en oksidase, ved bruk av molekylært oksygen (O2) for å oksidere molekyler som indol og β-penyletylamin, forløpere av tryptofanaminosyre og en nevrotransmitter, henholdsvis forløpere av tryptofanaminosyre og en nevrotransmitter, og en neurotransmitter, forløp av tryptofanaminosyre og en nevrotransmitter, og en nevrothylamin, forløp av tryptofan aminosyre og en nevrotransmitter, og en nevrotofan aminosyre og en nevrotransmitter, og en neurotransmitter, for eksempel å oksidere molekylen som indola og β-penyletylamin.
Noen konkurrerende hemmere av katalaseaktiviteten er for øyeblikket kjent, og blant dem skiller seg ut natrium og 3-amynotriazol azid. Azida er i sin anioniske form en kraftig hemmer av andre proteiner med hemo -grupper og brukes til eliminering eller forebygging av mikroorganismevekst under forskjellige forhold.
Struktur
Hos mennesker er katalase kodet av et 34 kb -gen som har 12 introner og 13 eksoner og koder for et 526 aminosyreprotein.
Flertallet av katalasene som er studert er tetrameriske enzymer med en molekylvekt nær 240 kDa (60 kDa for hver underenhet), og hver monomer er assosiert med en hemine eller ferrotoporfirin -protetisk gruppe.
Strukturen består av fire domener sammensatt av sekundære strukturer dannet av ALFA hellices og ß-pleide ark, og studier utført i enzymet til leveren til mennesker og storfe har vist at disse proteinene er koblet til fire NADPH-molekyler.
Disse NADPH -molekylene virker ikke viktige for den enzymatiske aktiviteten til katalase (for produksjon av vann og oksygen fra hydrogenperoksyd), men det ser ut til å være en reduksjon i følsomheten til dette enzymet sammenlignet med høye konsentrasjoner av dets toksiske substrat.
Domenene til hver underenhet i katalasen til mennesker er:
Kan tjene deg: karotenoider-En utvidet ikke-globulær N-terminal arm, som fungerer for stabiliseringen av den kvartære strukturen
-En ß-tønne på åtte ß-folds antiparalleller, som gir noen av laterale kryssrester til hemo-gruppen
-Et domene med "innpakning" som omgir det ytre domenet, inkludert hemokruppen og til slutt
-Et domene med alfa propellstruktur
De fire underenhetene, med disse fire domenene, er ansvarlige for dannelsen av en lang kanal hvis størrelse er kritisk for mekanismen for gjenkjennelse av hydrogenperoksyd av enzymet (som bruker aminosyrer som histidin, asparagin, glutamin og aspartinsyre for det ).
Funksjoner
Ifølge noen forfattere oppfyller Catalase to enzymatiske funksjoner:
-Nedbrytning av hydrogenperoksyd i molekylært vann og oksygen (som en spesifikk peroksidase).
-Oksidasjonen av protoner givere, så som metanol, etanol, mange formiske fenoler og syre, ved bruk av en mol hydrogenperoksyd (for eksempel en ikke -spesifikk peroksidase).
-Hos erytrocytter ser det ut til at den store mengden katalase spiller en viktig rolle i beskyttelsen av hemoglobin foran oksidasjonsmidler, så som hydrogenperoksyd, askorbinsyre, metylhydrazin og andre.
Enzymet som er til stede i disse cellene er ansvarlig for forsvaret av andre vev med liten katalaseaktivitet sammenlignet med høye konsentrasjoner av hydrogenperoksyd.
-Noen insekter som bomberbillen bruker katalase som en forsvarsmekanisme, ettersom hydrogenperoksyd dekomponerer og bruker gassform.
-I planter er katalase (også til stede i peroksisomer) en av komponentene i fotorerspirasjonsmekanismen, hvor fosfoglykat produsert av Rubisco-enzymet brukes til produksjon av 3-fosfoglyserat.
Kan tjene deg: loos syklusRelaterte patologier hos mennesker
De viktigste produksjonskildene av katalasesubstratet, hydrogenperoksyd, er reaksjonene katalysert av oksidaseenzymer, reaktive oksygenarter og noen tumorceller.
Denne forbindelsen er involvert i inflammatoriske prosesser, i uttrykk for limmolekyler, i apoptose, i reguleringen av blodplateaggregering og i kontrollen av celleproliferasjon.
Når det er mangler ved dette enzymet, genereres det høye konsentrasjoner av dets underlag, som produserer lesjoner i cellemembranen, defekter i elektronisk transport i mitokondrier, i metabolismen av homocystein og i DNA.
Blant sykdommene assosiert med mutasjoner i kodingsgenet for katalase av mennesker kan nevnes:
-Mellitus diabetes
-Arteriell hypertensjon
-Alzheimers
-Vitiligo og andre
Referanser
- Agar, n., Sadrzadeh, s., Findo, s., & Eaton, J. (1986). Erythrocyte Catalase. Et somatisk oksidantforsvar? J. Clin. Investere., 77, 319-321.
- Góth, l., Rass, s., & Betal til. (2004). Katalase enzymmutasjoner og deres tilknytning til design. Molekylær diagnose, 8(3), 141-149.
- Kirkman, h., & Gaetanit, G. F. (1984). Katalase: Et tetramerisk enzym med fire tett bundne molekyler av NADPH. Proc. Natl. Acade. Sci. BRUKER, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, G. F. (2006). Pattedyrkatalase: Venerable enzym med nye mysterier. Trender i biokjemiske vitenskaper, 32(1), 44-50.
- Rawn, J. D. (1998). Biokjemi. Burlington, Massachusetts: Neil Patterson Publisher.
- Solomon, e., Berg, l., & Martin, D. (1999). Biologi (5. utg.). Philadelphia, Pennsylvania: Saunders College Publishing.
- Vinshtein, f., Melik-Adamyan, w., Barynin, v., Vagin, a., & Grebenko, a. (1981). Tredimensjonal struktur av enzymet katalase. Natur, 293(1), 411-412.
- « Lacasas egenskaper, struktur, funksjoner
- Jevn akselererte rettlinjede bevegelsesegenskaper, formler »

