Galvaniske celledeler, hvordan fungerer, applikasjoner, eksempler

- 4666
- 976
- Marius Aasen
De Galvanisk celle o Voltaic Cell er en type elektrokjemisk celle som består av to forskjellige metaller nedsenket i to semi -llinger, der en forbindelse i aktiv løsning er en spontan reaksjon.
Deretter oksideres en av metallene i en av semi -llingene mens metallet til den andre semi -media reduseres, og produserer en utveksling av elektroner gjennom en ekstern krets. Dette gjør det mulig å dra nytte av elektrisk strøm.
 Figur 1. Ordning og deler av en galvanisk celle. Kilde: Korint.PUCP.Edu.PE.
Figur 1. Ordning og deler av en galvanisk celle. Kilde: Korint.PUCP.Edu.PE. Navnet på "galvanisk celle" er til ære for en av pionerene for eksperimentering med elektrisitet: den italienske legen og fysiologen Luigi Galvani (1737-1798).
Galvani oppdaget i 1780 at hvis de ble sammen med den ene enden av kabler av forskjellige metaller og de frie endene ble satt i kontakt med ANCA av en frosk (død), så skjedde det en sammentrekning.
Imidlertid var den første som bygde en elektrokjemi-celle for å produsere strøm også den italienske Alessandro Volta (1745-1827) i 1800 og derav det alternative navnet på Voltaic Cell.
Deler av den galvaniske cellen
Delene av en galvanisk celle er vist i figur 1 og er følgende:
1.- Anodisk semi -media
2.- Anodiumelektrode
3.- Anodisk løsning
4.- Katodisk semi -medisin
5.- Katodisk elektrode
6.- Katodisk løsning
7.- Saltbro
8.- Metallisk leder
9.- Voltmeter
Fungerer
For å forklare funksjonen til en galvanisk celle vil vi stole på den nedre:
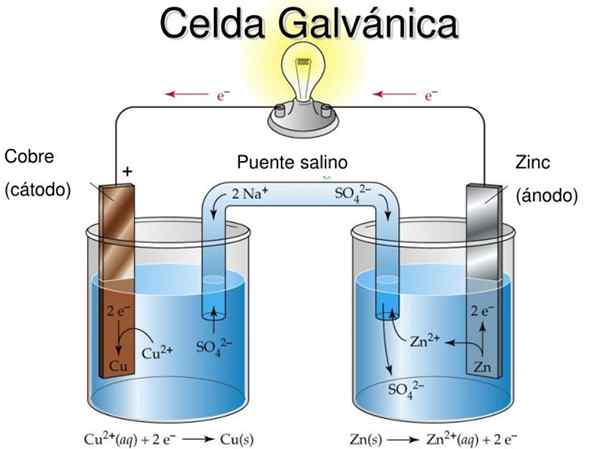 Figur 2. Galvanisk celle didaktisk modell. Kilde: Slideserve.com
Figur 2. Galvanisk celle didaktisk modell. Kilde: Slideserve.com Den grunnleggende ideen med en galvanisk celle er at metall , For eksempel for å tenne en pære eller LED.
I figur 2 i semi -media til venstre har du et metallisk kobberbånd (Cu) nedsenket i en kobbersulfatoppløsning (CUS04), Mens det i høyre semi -lid er et sinkbånd (Zn) nedsenket i en sinksulfatoppløsning (ZNSO4).
Det skal bemerkes at i hver semi -media er metallet til hver til stede i to oksidasjonstilstander: de nøytrale metallatomer og metallionene til saltet av samme metall i løsning.
Hvis metallbåndene ikke er koblet sammen med en utvendig ledende kabel, oksiderer begge metaller separat i sine respektive celler.
Imidlertid, når det er elektrisk tilkoblet, vil oksidasjon oppstå i Zn, mens det vil være en reduksjonsreaksjon i Cu. Dette er fordi graden av oksidasjon av sink er større enn kobber.
Metallet som oksiderer gir til metallet som reduseres gjennom den ytre lederen, og denne strømstrømmen kan brukes.
Kan tjene deg: halogenerte derivaterOksidasjons- og reduksjonsreaksjoner
Reaksjonen som oppstår på høyre side mellom sinkmetallelektroden og den vandige sinksulfatoppløsningen er som følger:
Znenten(S) + Zn2+ (SW4)2- → 2 Zn2+(AC) + (SW4)2- + 2 e-
Et atom av sink (fast) på overflaten av den anodiske elektroden i semi -rettigheten til høyre, stimulert av de positive ionene i sink i oppløsningen, gir to elektroner og kommer frem fra elektroden, og går til den vandige løsningen som et positivt dobbeltion av sink.
Vi innså at nettoresultatet var at et atom av nøytralt metall -sink, ved å miste to elektroner, ble et ion av sink som gir den vandige oppløsningen, slik at sinkstangen mistet et atom og løsningen skaffet seg et positivt dobbeltion.
Fiberte elektroner vil foretrekke å bevege seg gjennom den ytre kabelen mot metallet til den andre semi -media med positiv belastning (CartoDo +). Sinkstangen mister massen siden atomene gradvis passerer til den vandige løsningen.
Sinkoksidasjon kan oppsummeres som følger:
Znenten(S) → Zn2+(AC) + 2 e-
Reaksjonen som oppstår på venstre side er lik, men kobber av den vandige oppløsningen fanger opp to elektroner (kommer fra den andre semi -temaet) og blir avsatt i kobberelektroden. Når et atom fanger opp elektroner, sies det å være redusert.
Kobberreduksjonsreaksjonen er skrevet slik:
Cu2+(AC) + 2 e- → Cuenten(S)
Kobberstangen får deig, siden ionene av løsningen passerer til stangen.
Oksidasjon forekommer i anoden (negativ), som frastøter elektroner, mens reduksjonen oppstår i katode (positivt), som tiltrekker elektroner. Elektronutveksling skjer gjennom den eksterne driveren.
Saltbroen
Saltbroen balanserer belastningene som akkumuleres i de to semi -liesene. I de anodiske semi -diad -positive ionene akkumuleres, mens det i katodisk er et overskudd av negative sulfationer.
For saltbroen brukes en løsning av et salt (for eksempel natriumklorid eller kaliumklorid) som ikke griper inn i reaksjonen, som er i et omvendt u -form formet rør med endene plugget med en vegg av porøst materiale.
Det eneste formålet med saltvannsbroen er at ionene skal filtreres til hver cellebalansering eller nøytraliserende overflødig belastning. Gjennom saltbroen er det således en strømstrøm, gjennom saltvannsionene, som lukker den elektriske kretsen.
Oksidasjons- og reduksjonspotensialer
Standard oksidasjons- og reduksjonspotensialer forstås.
Det kan tjene deg: Scandio: Historie, egenskaper, reaksjoner, risikoer og bruksområderFor sink er dets standard oksidasjonspotensialokse = +0,76 v. I mellomtiden er standard reduksjonspotensialet for kobber ogNett = +0.34 v. Elektromotivkraften (FEM) produsert av denne galvaniske cellen er: FEM = +0,76 V + 0,34 V = 1,1 V.
Den globale reaksjonen fra den galvaniske cellen kan skrives slik:
Znenten(S) + Cu2+(AC) → Zn2+(AC) + Cuenten(S)
Å ta sulfat i betraktning netto reaksjon er:
Znenten(S) + Cu2+ (SW4)2- 25 ºC → Zn2+ (SW4)2-+ Cuenten(S)
Sulfat er en tilskuer, mens metaller utveksler elektroner.
Symbolsk representasjon av en galvanisk celle
Den galvaniske cellen i figur 2 er symbolsk representert som følger:
Znenten(S)| Zn2+(AC) (1m) || Cu2+(AC) (1 m) | Cuenten(S)
Ved konvensjon, til venstre for metallet som oksiderer og danner anoden (-) og atskilt med en stang (|), er dets ion i vandig tilstand alltid plassert. Den anodiske semi -medium er atskilt fra katodisk med to stolper (||) som representerer saltvannsbroen. Til høyre er metall semi -medium som er redusert og danner katoden (+) plassert.
I den symbolske representasjonen av en galvanisk celle er enden alltid metallet som oksiderer og på slutten er metallet plassert (i fast tilstand) som reduseres. Det skal bemerkes at i figur 2 er semiklene i revers med hensyn til konvensjonell symbolsk representasjon.
applikasjoner
Kjent standardoksidasjonspotensialene til forskjellige metaller er det mulig å bestemme elektromotorkraften som vil produsere en galvanisk haug bygget med disse metallene.
I dette avsnittet vil ovennevnte gjelde i de foregående seksjonene for å beregne netto elektromotorisk kraft til en celle bygget med andre metaller.
Som et eksempel på anvendelse vurderer vi en galvanisk jerncelle (tro) og kobber (CU). Som data blir følgende reduksjonsreaksjoner og dets standard reduksjonspotensial gitt, det vil si ved 25 ºC og 1M konsentrasjon:
Tro2+(AC) + 2 e- → Tro(S). E1Nett = -0,44 v
Cu2+(AC) + 2 e- → Cu(S). E2Nett = +0.34 v
Det blir bedt om å finne netto elektromotorisk kraft produsert av følgende galvaniske celle:
Tro(S)| Tro2+(AC)(1 m) || cu2+(AC)| Cu(S)
I denne haugen oksideres jernet og er anoden til den galvaniske cellen, mens kobberet reduseres og er katoden. Jernoksidasjonspotensialet er det samme, men i motsetning til dets reduksjonspotensial, det vil si E1OXD = +0.44.
For å oppnå elektromotorkraften produsert av denne galvaniske cellen, legger vi til jernoksidasjonspotensialet med kobberreduksjonspotensialet:
Kan tjene deg: Nitrogenoksider (NOX)FEM = E1OXD + E2Nett = -E1Nett + E2Nett = 0,44 V + 0,34 V = 0,78 V.
Galvanisk celle i dagliglivet
Galvaniske celler for daglig bruk er langt fra den formen som brukes som en didaktisk modell, men deres operasjonsprinsipp er det samme.
Den vanligste brukscellen er 1,5V alkalisk batteri i sine forskjellige presentasjoner. Fornavnet kommer fordi det er et sett med celler koblet i serie for å øke FEM.
Oppladbare litiumbatterier er også basert på det samme prinsippet om drift av galvaniske celler og er de som brukes i smarttelefoner, klokker og andre enheter.
På samme måte er blybatteriene til biler, motorsykler og båter 12V og er basert på samme prinsipp for drift av den galvaniske cellen.
Galvaniske celler brukes i estetikk og muskelregenerering. Det er ansiktsbehandlinger som består av å bruke strøm av to elektroder i form av en rull eller sfære som rengjør og tonifiserer huden.
Nåværende pulser gjelder også for å regenerere muskulaturen hos mennesker som er i en tilstand av utmattelse.
Konstruksjon av en hjemmelaget galvanisk celle
Det er mange måter å bygge en hjemmelaget galvanisk celle. En av de enkleste er å bruke eddik som en løsning, stål negler og kobberkabler.
Materialer
-Engangsplastfartøy
-hvit eddik
-To stålskruer
-To stykker naken kobbertråd (uten isolering eller lakk)
-Et voltmeter
Fremgangsmåte
-Fyll ¾ deler av glasset med eddik.
-Bli med i de to stålskruene med flere ledninger, etterlater et stykke ledning uten svingete.
Den uendelige enden av kobberkabelen er brettet i en omvendt u -formet.
 Figur 3. Hjemmelaget galvanisk celle og multimeter. Kilde: YouTube.com
Figur 3. Hjemmelaget galvanisk celle og multimeter. Kilde: YouTube.com Et annet stykke kobberkabel er også brettet inn i en omvendt og henger på kanten av glasset i diametralt motsatt stilling til de nedsenkede skruene, slik at den ene delen av kobberet er inne i eddik og den andre delen av kobberkabelen på utsiden av glasset.
De frie endene av voltmeterkablene er koblet for å måle elektromotorkraften produsert av denne enkle cellen. FEM av denne typen celle er 0,5V. For å matche fem av et alkalisk batteri, er det nødvendig å bygge ytterligere to celler og bli med de tre i serie, slik at et 1,5V batteri oppnås
Referanser
- Borneo, r. Galvaniske og elektrolytiske celler. Hentet fra: Quimica -klasser.Blogspot.com
- Cedrón, J. Generell kjemi. PUCP. Gjenopprettet fra: Korint.PUCP.Edu.PE
- Farrera, l. Introduksjon til elektrokjemi. UNAM Physic -Heicemistry Department. Gjenopprettet fra: Depa.Fquim.Unam.MX.
- Wikipedia. Elektrokjemisk celle. Gjenopprettet fra: er.Wikipedia.com.
- Wikipedia. Galvanisk celle. Gjenopprettet fra: er.Wikipedia.com.

