Elektrokjemiske celler

- 601
- 26
- Magnus Sander Berntsen
Hva er elektrokjemiske celler?
De Elektrokjemiske celler De er enheter der kjemiske reaksjoner passerer der kjemisk energi forvandles til strøm eller omvendt. Disse cellene utgjør hjertet av elektrokjemi, og sjelen er den potensielle utvekslingen av elektroner som kan oppstå, spontan eller ikke spontant, mellom to kjemiske arter.
Den ene av de to artene oksiderer, mister elektroner, mens den andre reduseres ved å vinne de avgitte elektronene. Vanligvis er arten som reduseres en metallisk kation i oppløsningen, som ved å få elektrisk ender opp med å bli elektrisk på en elektrode laget av samme metall. På den annen side er arten som oksiderer et metall, og blir metallkationer.
 Daniels elektrokjemiske cellediagram. Kilde: Rechua [CC av (https: // creativeCommons.Org/lisenser/av/3.0)]
Daniels elektrokjemiske cellediagram. Kilde: Rechua [CC av (https: // creativeCommons.Org/lisenser/av/3.0)] For eksempel representerer det overlegne bildet Daniels celle: den enkleste av alle elektrokjemiske celler. Den metalliske sinkelektroden oksyderes, frigjør Zn -kationer2+ til det vandige miljøet. Dette skjer i ZnSO -beholderen4 fra venstre.
Til høyre er løsningen som inneholder CUO4 Det reduseres, transformerer kationer Cu2+ I metallisk kobber som er avsatt på kobberelektroden. Under utviklingen av denne reaksjonen reiser elektroner en ekstern krets som aktiverer mekanismene sine; Og derfor leverer strøm for drift av utstyr.
Elektrokjemiske cellekomponenter
Elektroder
I elektrokjemiske celler genereres eller konsumeres. For å sikre riktig strøm av elektroner må det være materialer som er gode strømledere. Det er her elektroder og ekstern krets kommer, utstyrt med kobberledninger, sølv eller gull.
Elektrodene er materialene som gir overflaten der reaksjoner i elektrokjemiske celler vil bli utviklet. Det er to typer i henhold til reaksjonen som oppstår i dem:
- Anode, elektrode hvor oksidasjon oppstår.
- Katode, elektrode der reduksjonen oppstår.
Elektrodene kan være laget av et reaksjonsmateriale, som for Daniels celle (sink og kobber); eller, av et inert materiale, som tilfellet er når de er laget av platina eller grafitt.
Elektroner tildelt av anoden må nå katoden; Men ikke gjennom en løsning, men å reise en metallkabel som feller begge elektroder til en ekstern krets.
Elektrolyttoppløsning
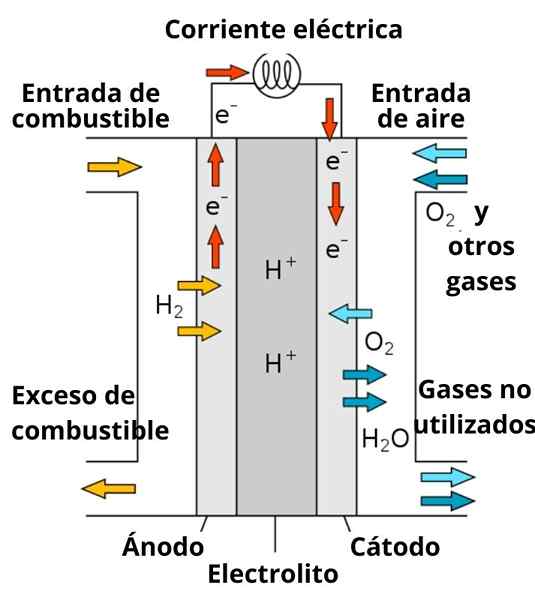 Opplegg av et protons ledende drivstoffbatteri
Opplegg av et protons ledende drivstoffbatteri Oppløsningen som omgir elektrodene spiller også en viktig rolle, ettersom den er beriket med sterke elektrolytter; slik som: KCl, KNO3, NaCl, etc. Disse ionene favoriserer til en viss grad migrasjonen av elektroner fra anoden til katoden, så vel som deres ledning i nærheten av elektrodene for å samhandle med arten for å redusere.
Sjøvann fører for eksempel mye bedre strøm enn destillert vann, med lavere ionekonsentrasjon. Det er grunnen til at elektrokjemiske celler har en løsning av sterke elektrolytter blant komponentene sine.
Saltbro
Løsningenes ioner begynner å omgi elektrodene som forårsaker en polarisering av belastningene. Oppløsningen rundt katoden begynner å lade negativt, ettersom kationer reduseres; I tilfelle av Daniels celle, CU -kationer2+ Ved å avsette som et metallisk kobber på katoden. Dermed er det underskudd på positive anklager.
Det er her saltbroen griper inn for å balansere belastningene og forhindre at elektrodene blir polarisert. Til siden eller rommet til katodekationene til saltvannsbroen vil migrere, enten k+ eller Zn2+, Å erstatte Cu2+ konsumert. I mellomtiden vil ikke fra saltvannsbroen migrere anioner3- Mot anoderommet, for å nøytralisere den voksende konsentrasjonen av Zn -kationer2+.
Det kan tjene deg: kaliumdikromat: formel, egenskaper, risikoer og bruksområderSaltvannsbroen er sammensatt av en mettet saltoppløsning, med endene dekket av en permeabel ionegel, men vanntett for vann.
Typer elektrokjemiske celler og hvordan de fungerer
Måten en elektrokjemisk celle fungerer på, avhenger av den typen som er. Det er grunnleggende to typer: galvanisk (eller voltaisk) og elektrolytisk
Galvanikk
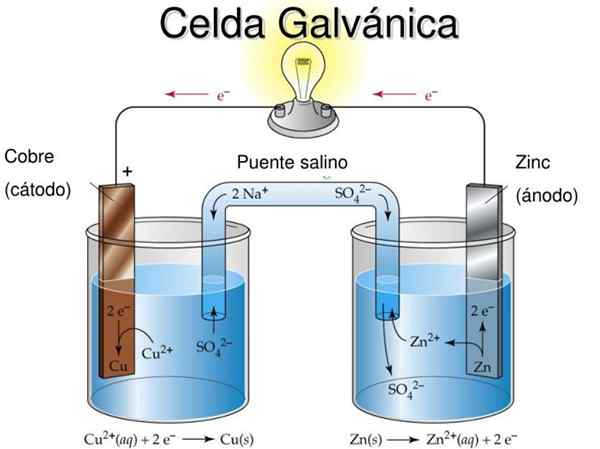
Daniels celle er et eksempel på en galvanisk elektrokjemi -celle. I dem oppstår reaksjonene spontant, og potensialet til batteriet er positivt; Jo større potensial, jo større er strømmen som vil levere cellen.
Batteriene eller batteriene er nøyaktig galvaniske celler: det kjemiske potensialet mellom de to elektrodene blir transformert til elektrisk energi når en ekstern krets griper inn som forbinder dem. Dermed vandrer elektroner fra anoden, tenner utstyret som batteriet er koblet til, og returneres direkte til katoden.
Elektrolytisk
Elektrolytiske celler er de hvis reaksjoner ikke forekommer spontant, med mindre de leveres av elektrisk energi fra en ekstern kilde. Her oppstår det motsatte fenomenet: Elektrisitet lar ikke -spontane kjemiske reaksjoner utvikle seg.
En av de mest kjente og verdifulle reaksjonene som foregår i denne typen celle er elektrolyse.
Oppladbare batterier er eksempler på elektrolytiske og samtidig galvaniske: de blir ladet for å snu de kjemiske reaksjonene og gjenopprette de opprinnelige forholdene som skal gjenbruke igjen.
Eksempler
Daniels celle
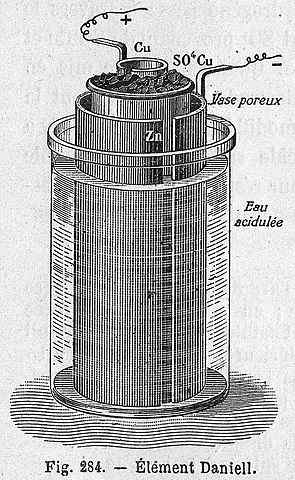 Daniels celleopplegg
Daniels celleopplegg Følgende kjemiske ligning tilsvarer reaksjonen fra Daniels celle der sink og kobber deltar:
Kan tjene deg: leie halogenuros: egenskaper, innhenting, eksemplerZn (S) + Cu2+(aq) → Zn2+(aq) + cu (s)
Men CU -kationer2+ og Zn2+ De er ikke alene, men ledsaget av SO -anionene42-. Denne cellen kan representeres som følger:
Zn | Znso4 | | Cuso4 | Cu
Daniels celle kan bygges i et hvilket som helst laboratorium, og er veldig tilbakevendende som en praksis i introduksjonen av elektrokjemi. Som Cu2+ Den er avsatt som CU, den blå fargen på CUSO -løsningen4 Det vil gå tapt.
Platinum og hydrogencelle
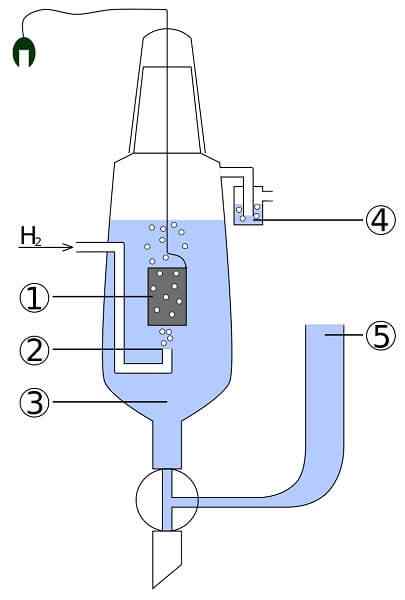 Skjema for en platina- og hydrogencelle: 1. 2 Platinumelektrode. Hydrogengass 3. Syreløsning 4. Hidroseal 5. Unionsinnskudd
Skjema for en platina- og hydrogencelle: 1. 2 Platinumelektrode. Hydrogengass 3. Syreløsning 4. Hidroseal 5. Unionsinnskudd Se for deg en celle som bruker gassformig hydrogen, produserer metallsølv, og samtidig tar det strøm. Dette er platina- og hydrogencellen, og dens generelle reaksjon er som følger:
2Agcl (S) + H2(g) → 2AG (S) + 2H+ + 2cl-
Her i anode -rommet har vi en inert platinaelektrode, nedsenket i vann og til hvilken gasshydrogen pumpes. H2 Bli oksidert til H+ og gir elektronene til Agcls melkeaktig bunnfall i katodekalmen med et metall sølvelektrode. AGCL vil bli redusert på dette sølvet og elektrodedeigen vil øke.
Denne cellen kan representeres som:
Pt, h2 | H+ | | Cl-, Agcl | AG
Downs Cell
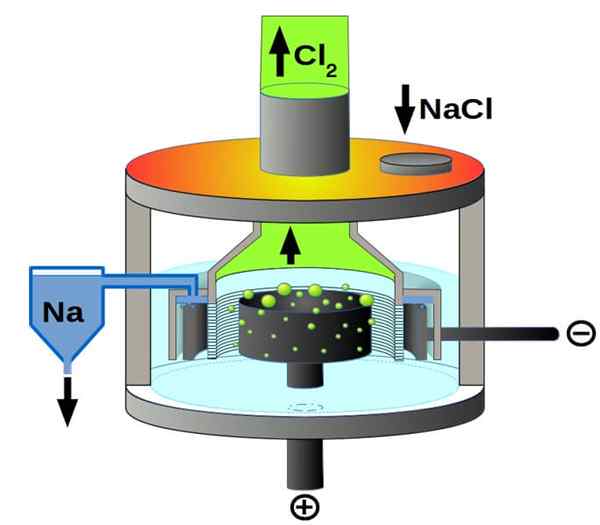 Downs Cell Scheme for natriumkloridelektrolyse. Kilde: Pchemiker, CC BY-SA 4.0, via Wikimedia Commons
Downs Cell Scheme for natriumkloridelektrolyse. Kilde: Pchemiker, CC BY-SA 4.0, via Wikimedia Commons Og til slutt, blant de elektrolytiske cellene, har vi det smeltede natriumkloridet, bedre kjent som Downs Cell. Her er det laget elektrisitet for å reise gjennom elektrodene et volum av smeltet NaCl, og har dermed opp i dem følgende reaksjoner:
2+(l) + 2e- → 2NA (S) (katode)
2cl-(L) → CL2(g) + 2e- (Anode)
2NaCl (L) → 2NA (S) + CL2(g) (Global reaksjon)
Dermed kan takket være elektrisitet og natriumklorid, metallisk natrium og klorgass fremstilles.

