Sentriolosfunksjoner og egenskaper
- 1602
- 348
- Marius Aasen

De Centriolos De er sylindriske cellestrukturer sammensatt av mikrotubuli -grupper. De er dannet av tubulinproteinet, som finnes i de fleste eukaryote celler.
Et tilknyttet par sentriler, omgitt av en masserapport av tett materiale som kalles pericentriolar materiale (PCM), komponerer en struktur kalt sentrum.
Sentrioles funksjon er å lede montering av mikrotubulene, delta i den cellulære organisasjonen (plassering av kjernen og romlig disposisjon av cellen), dannelse og funksjon av flagella og cilia (cylogenese) og celledeling (mitose og meiose).
Sentrioloer finnes i cellulære strukturer kjent som dyreceller og er fraværende i planteceller.
Defekter i strukturen eller antall sentrioler i hver celle kan ha betydelige konsekvenser for fysiologien til en organisme, noe.
En sentriole er en sylindrisk struktur. Et par tilknyttede sentrioler, omgitt av en masserapport av tett materiale (kalt "pericentriolar materiale", eller PCM), danner en sammensatt struktur kalt "sentre".
De anså seg som uviktige inntil for noen år siden, da hovedorganellene ble avsluttet i gjennomføringen av celledeling og duplisering (mitose) i eukaryote celler (hovedsakelig hos mennesker og andre dyr).
Sentriol
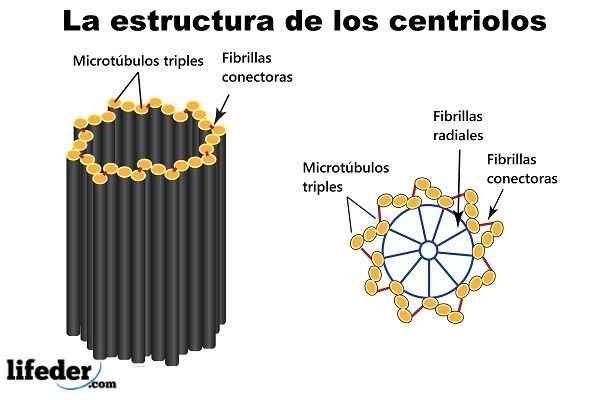
Ni mikrotubuli -trillinger anordnet rundt en omkrets (danner en kort hul sylinder), er "konstruksjonsblokkene" og hovedstrukturen til en sentriol.
I mange år ble strukturen og funksjonen til sentriolene ignorert, selv om sentrene i 1880 -årene hadde blitt visualisert ved optisk mikroskopi.
Theodor Boveri publiserte et sædarbeid i 1888, og beskrev sentrene fra sædes opprinnelse etter befruktning. I sin korte kommunikasjon i 1887 skrev Boveri at:
“Sentrering representerer det dynamiske sentrum av cellen; Delingen skaper sentrene for dattercellene som er dannet, som alle andre cellekomponenter er organisert symmetrisk ... sentrene er det sanne divisororganet i cellen, han halve kjernefysisk og cellulær divisjon ”(Scheer, 2014: 1). [Forfatteroversettelse].
Kort tid etter midten av århundret, med utvikling av elektronisk mikroskopi, ble oppførselen til sentriolene studert og forklart av Paul Schafer.
Dessverre ble dette arbeidet ignorert i stor grad på grunn av at forskernes interesse begynte å fokusere på funnene fra Watson og Krick på DNA.
Senteret

Et par sentrioler, som ligger ved siden av kjernen og vinkelrett på hverandre, er "en sentrering". Et av sentriolene er kjent som "faren" (eller mor). Den andre er kjent som "sønnen" (eller datteren; den er litt kortere, og har basen festet til mors base).
De proksimale endene (i forbindelsen mellom de to sentriolene) er nedsenket i en "sky" av protein (kanskje opptil 300 eller mer) kjent som Microtubules Organization Center (MTOC), siden det gir det nødvendige proteinet for konstruksjon av det mikrotubuli.
Kan tjene deg: Levedyktighet av forskningMTOC er også kjent som "pericentriolar materiale", og har en negativ belastning. Omvendt, de distale ender (vekk fra forbindelsen mellom de to sentriolene) er positivt lastet.
Paret av sentrioler, sammen med den omkringliggende MTOC, er kjent som "senteret".
Duplisering av sentrene
Når sentriolene begynner å duplisere, skiller faren og sønnen seg litt, og deretter begynner hver sentriole å danne en ny sentriolo i sin base: Faderen med en ny sønn, og sønnen med en ny sønn (et "barnebarn" " ).
Mens dupliseringen av sentriolen skjer, dupliserer og separert kjernen. Det vil si at dagens forskning viser at duplisering av sentriolen og separasjonen av DNA på en eller annen måte er koblet.
Duplisering og celledeling (mitose)

Den mitotiske prosessen er ofte beskrevet i form av en initiativfase, kjent som "grensesnitt", etterfulgt av fire utviklingsfaser.
Under grensesnittet er sentriolene doble og skiller seg inn i to par (en av disse jevnaldrende begynner å bevege seg mot motsatt side av kjernen) og DNA er delt.
Etter dupliseringen av sentriolene, strekker mikrotubulene i sentriolene seg og justerer langs kjernenes viktigste akse, og danner den "mitotiske spindelen".
I den første av de fire utviklingsfasene (fase I eller "profas"), begynner kromosomene kondens og tilnærming, og kjernefysisk membran begynner å svekkes og oppløse. Samtidig dannes den mitotiske spindelen med sentriolparene som nå ligger i endene av spindelen.
I den andre fasen (fase II eller "metafase") er kromosomkjedene på linje med aksen til den mitotiske spindelen.
I den tredje fasen (fase III eller "anafase") er kromosomkjedene delt og beveger seg mot motsatte ender av mitotisk spindel, nå langstrakt.
Til slutt, i den fjerde fasen (fase IV eller "telofase"), dannes nye kjernefysiske membraner rundt de separate kromosomene, den mitotiske spindelen blir angret og celleseparasjonen begynner å bli fullført med halvparten av cytoplasma som følger med hver nye kjerne.
I hver ende av den mitotiske spindelen har sentriolpar en viktig innflytelse (tilsynelatende relatert til kreftene som utøves av de elektromagnetiske felt generert av de negative og positive belastningene i deres proksimale og distale ender) i hele celledelingen.
Sentrene og immunresponsen
Stresseksponering påvirker funksjonen, kvaliteten og varigheten av livet til en organisme. Det genererte stresset, for eksempel ved en infeksjon, kan føre til betennelse i infisert vev, og aktiverer immunresponsen i kroppen. Denne responsen beskytter det berørte kroppen, og eliminerer patogenet.
Mange aspekter ved immunsystemets funksjonalitet er velkjente. Imidlertid er molekylære, strukturelle og fysiologiske hendelser der sentrene er involvert fortsatt et gåte.
Kan tjene deg: eksperimentrapportNyere studier har oppdaget uventede dynamiske endringer i strukturen, plasseringen og funksjonen til sentrene under forskjellige forhold relatert til stress. For eksempel, etter imitasjon av forholdene til en infeksjon, er det funnet en økning i PCM -produksjon og mikrotubuli i grensesnittceller.
Sentrene i immunsynapser
Sentrene har en veldig viktig rolle i strukturen og funksjonen til immunsynapser (SI). Denne strukturen dannes ved spesialiserte interaksjoner mellom en T -celle og en antigen som presenterer celle (CPA). Denne cellecelleinteraksjonen begynner migrasjonen av sentrering mot SI og dens påfølgende kobling til plasmamembranen.
Senterkobling i SI ligner på den som ble observert under cylogenese. I dette tilfellet begynner det imidlertid ikke sammenstillingen av cilia, men deltar i organisasjonen av SI og sekresjonen av cytotoksiske vesikler for å lisar målcellene, og bli et nøkkelorgan i aktiveringen av T -celler.
Sentrum og varmestress
Sentrene er målet for "chaperonas molekylær" (et sett med protein hvis funksjon er å hjelpe til med å brette montering og celletransport av andre proteiner) som gir beskyttelse mot eksponering for termisk sjokk og stress.
Blant stressfaktorene som påvirker sentrene, er skaden på DNA og varme inkludert (for eksempel den som er påført av feberpasientceller). DNA -skade begynner DNA -reparasjonsveier, noe som kan påvirke funksjonen til sentre og proteinsammensetning.
Stress generert av varme forårsaker modifisering av strukturen til sentriolen, forstyrrelsen av sentrene og fullstendig inaktivering av dens evne til å danne mikrotubuli, endre dannelsen av mitotisk spindel og forhindre myitose.
Avbrudd i sentrefunksjonen under feber kan være en adaptiv reaksjon for å inaktivere spindelstolene og forhindre den unormale inndelingen av DNA under mitose, spesielt gitt den potensielle dysfunksjonen av flere proteiner etter den varmeinduserte denaturering.
Det kan også gi cellen ut for å gjenopprette det funksjonelle proteinbassenget før du starter celledelingen på nytt.
En annen konsekvens av inaktiveringen av sentrering under feber er dens manglende evne til å flytte til IS å organisere den og delta i sekresjonen av cytotoksiske vesikler.
Unormal utvikling av sentrioler
Utviklingen av sentriolo er en prosess er ganske kompleks, og selv om en serie regulerende proteiner deltar i den, kan forskjellige typer feil oppstå.
Hvis det er en ubalanse i andelen proteiner, kan sentriolo -barnet være mangelfullt, dets geometri kan forvrenges, aksene til et par kan avvike fra vinkelrett, flere barn kan utvikle seg, sentriolens sønn kan nå full lengde før tiden, eller avkoblingsparene kan bli forsinket.
Det kan tjene deg: Naturlig og sosialt miljø i tilfredsstillelse av menneskelige behovNår det er feil eller feilaktig duplisering av sentrioler (med geometriske defekter og / eller multippel duplisering), blir DNA -replikasjon endret, kromosomal ustabilitet presenteres (CIN).
På samme måte fører sentre for sentrene (for eksempel en forstørret eller utvidet sentrering) til CIN, og fremmer utviklingen av flere sentrioler barn.
Disse utviklingsfeilene genererer skade på celler som til og med kan føre til ondartet.
Unormale sentrioler og ondartede celler
Takket være intervensjonen av regulatoriske proteiner, når avvik blir oppdaget i utviklingen av sentrioler og/eller sentrering, kan celler implementere selvkorreksjon av anomalier.
Imidlertid, hvis selvkorreksjon av anomali, kan unormale sentrioler eller med flere barn ("Supernumerary centrioles" oppnås) føre til generering av svulster ("tumorigenese") eller celledød.
Supernumerære sentrioler har en tendens til å komme sammen, noe.
Celler med supernumerære sentrioler karakteriseres ved å presentere et overflødig pericentriolarmateriale, avbrudd i den sylindriske strukturen eller overdreven lengde på ikke -perpendikulær eller dårlig plasserte sentrioler og sentrioler.
Det har blitt antydet at klyngene til sentrioler eller sentre i kreftceller kan tjene som en "biomarkør" i bruk av terapeutiske og fantasologiske midler, for eksempel super-paramagnetiske nanopartikler.
Referanser
- Borisy, g., Heald, r., Howard, J., Janke, c., Musacchio, a., & Nogales, og. (2016). Mikrotubuli: 50 år fra oppdagelsen av tubulin. Nature Reviews Molecular Cell Biology, 17 (5), 322-328.
- Buchwalter, r. TIL., Chen, J. V., Zheng, og., & Megraw, t. L. Sentre i celledeling, utvikling og sykdom. Els.
- Gambarotto, d., & Basto, r. (2016). Konskaper av numeriske sentre defekter i utvikling og sykdom. I mikrotubulus cystoskjelett (pp. 117-149). Springer Wien.
- Huston, r. L. (2016). En gjennomgang av sentriolaktivitet og urettmessig aktivitet, under celledelingen. Fremskritt innen biovitenskap og bioteknologi, 7 (03), 169.
- Inaba, k., & Mizuno, K. (2016). Sperm dysfunksjon og ciliopati. Reproduktiv medisin og biologi, 15 (2), 77-94.
- Keeling, J., Tsiokas, l., & Maskey, D. (2016). Cellulære mekanismer for ciliær lengdekontroll. Celler, 5 (1), 6.
- Lodish, h., Berk, a., Kaiser, ca. TIL., Krieger, m., Bretscher, a., Ploegh, h., Amon, a., Martin, k. C. (2016). Molekylær cellebiologi. New York: W. H. Freeman og selskap.
- Matamoros, a. J., & Baas, P. W. (2016). Mikrotubuli i helse- og degenerativ sykdom i nervesystemet. Hjerneforskningsbulletin, 126, 217-225.
- Pellegrini, l., Wetzel, a., Grannó, s., Heaton, g., & Harvey, K. (2016). Tilbake til tubulen: Mikrotubuledynamikk ved Parkinsons sykdom. Cellular and Molecular Life Sciences, 1-26.
- Scheer, u. (2014). Historiske røtter til Centers Research: Discovery of Boveris mikroskop glir i Würzburg. Phil. Trans. R. Soc. B, 369 (1650), 20130469.

