Kaliumcyanid (KCN) egenskaper, bruksområder, strukturer, risikoer,

- 2324
- 466
- Oliver Christiansen
Han Kaliumcyanid Det er en uorganisk forbindelse dannet av en ionekalium k+ og et CN -cyanidion-. Den kjemiske formelen er KCN. Det er et krystallinsk hvitt fast, ekstremt giftig.
KCN er veldig løselig i vann, og når den oppløses, er den hydrolysert og danner cyanhydrinsyre eller HCN hydrogensyanid, noe som også er veldig giftig. Kaliumcyanid kan danne sammensatte salter med gull og sølv, slik at det ble brukt til å trekke ut disse edle metaller fra visse mineraler.
 Solid KCN kaliumcyanid. Morienus (lastet opp av DE: Benutzer: BXXXD fra: Wiki) [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons.
Solid KCN kaliumcyanid. Morienus (lastet opp av DE: Benutzer: BXXXD fra: Wiki) [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons. KCN brukes til å dekke billige metaller med gull og sølv gjennom en elektrokjemisk prosess, det vil si en metode der en elektrisk strøm føres gjennom en løsning som inneholder et salt sammensatt av edelt metall, cyanid og kalium.
Kaliumcyanid fordi det inneholder cyanid må manipuleres med stor forsiktighet, med tilstrekkelige redskaper. Det skal aldri kastes til miljøet, fordi det også er veldig giftig for de fleste dyr og planter.
Metoder som bruker vanlige alger blir imidlertid studert for å fjerne forurenset vannkaliumcyanid med lave konsentrasjoner av dette.
[TOC]
Struktur
KCN er en ionisk forbindelse dannet av en kaliumkation k+ og en cyanidanion CN-. I dette er karbonatomet knyttet til nitrogenatom gjennom en trippel kovalent binding.
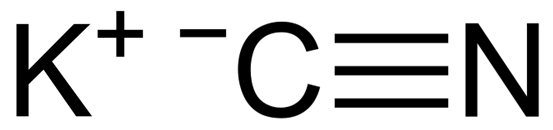 KCN kaliumcyanid kjemisk struktur. Capacio [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
KCN kaliumcyanid kjemisk struktur. Capacio [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. I fast kaliumcyanid CN -anionen- Det kan rotere fritt av det som oppfører seg som en sfærisk anion, som en konsekvens har KCN -krystallen en kubikkstruktur som ligner på KCL -kaliumklorid.
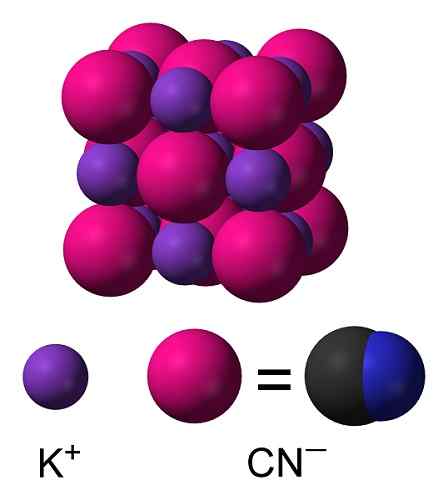 KCN krystallstruktur. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
KCN krystallstruktur. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. Nomenklatur
- Kaliumcyanid
- Kaliumcyanid
- Cianopotasio
Egenskaper
Fysisk tilstand
Hvit krystallinsk faststoff. Kubikkkrystaller.
Molekylær vekt
65,116 g/mol.
Smeltepunkt
634,5 ° C
Det kan tjene deg: aluminiumsulfat (AL2 (SO4) 3)Kokepunkt
1625 ° C.
Tetthet
1,55 g/cm3 ved 20 ° C.
Løselighet
Veldig løselig i vann: 716 g/l ved 25 ° C og 100 g/100 ml vann ved 80 ° C. Lite oppløselig i metanol: 4,91 g/100 g metanol ved 19,5 ° C. Svært lite oppløselig i etanol: 0,57 g/100 g etanol ved 19,5 ° C.
Ph
En vandig løsning på 6,5 g KCN i 1 l vann har en pH på 11,0.
Hydrolyse konstant
KCN er veldig løselig i vann. Når cyanidionen CN er gratis- som tar en proton h+ vann for å danne hcn cyanhydrinsyre og frigjøre et OH -ion-:
CN- + H2O → HCN + OH-
Hydrolysekonstanten indikerer at trenden som nevnte reaksjon utføres.
Kh = 2,54 x 10-5
KCN vandige oppløsninger frigjør HCN -hydrogensyanidmiljøet når de varmer opp 80 ° C.
Kjemiske egenskaper
Det er ikke brannfarlig, men når den faste KCN varmes opp til nedbrytningen avgir veldig giftig HCN hydrogencyanid, gjør ikke nitrogenoksiderx, K -potassiumoksid2O og karbonmonoksid.
KCN reagerer med gullsalter som danner kalium Aurocianuro Kau (CN)2 og kalium Auricianuro Kau (CN)4. Dette er komplekser fargeløse salter. Med Silver Metal AG danner KCN kalium Argentocyanide KAG (CN)2.
KCN -cyanidion reagerer med visse organiske forbindelser som har halogen (for eksempel klor eller brom) og opptar stedet for disse. For eksempel reagerer den med bromeddiksyre for å gi cyanoeddiksyre.
Andre egenskaper
Det er hygroskopisk, absorberer miljøet i miljøet.
Den har en myk lukt av bitre mandler, men dette oppdages ikke av alle mennesker.
Å skaffe
KCN er fremstilt av KOH kaliumhydroksydreaksjon i vandig løsning med HCN hydrogencyanid. Kaliumferrocyanid K oppnås også ved oppvarming4Tro (CN)6:
K4Tro (CN)6 → 4 kcn + 2 c + n2↑ + tro
Bruk i metallelektrode
Det brukes i prosessen med å dekke lite verdifulle metaller med gull og sølv. Det er en elektrolytisk prosess, det vil si at strøm føres gjennom en vandig løsning med passende salter.
Det kan tjene deg: Svoveltrioksid (SO3): Struktur, egenskaper, risikoer, brukSølv
Kalium Argentocyanide KAG (CN) brukes2 Til belegg med billigere metaller (AG).
Disse er plassert i en vandig løsning av kaliumkag (CN)2, Der den positive anoden eller stolpen er en ren sølvstang (Ag) og katoden eller den negative polen er det billige metallet som er ønsket å belegge sølv.
Når en elektrisk strøm går gjennom løsningen, blir sølv avsatt på det andre metallet. Når cyanidsalter brukes, blir sølvlaget avsatt på en finere, mer kompakt og tilhørende måte enn i løsninger av andre forbindelser.
 Noen smykkeartikler er dekket med sølv ved hjelp av KCN -salter. Forfatter: StockSnap. Kilde: Pixabay.
Noen smykkeartikler er dekket med sølv ved hjelp av KCN -salter. Forfatter: StockSnap. Kilde: Pixabay. Gull
Tilsvarende når det gjelder gull (AU), kalium aurocyanid Kau (CN)2 og kalium Auricianuro Kau (CN)4 Andre metaller brukes til å elektrolytisk brune.
 Elektriske kontakter belagt med gull muligens ved bruk av KCN -salter. CJP24 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Elektriske kontakter belagt med gull muligens ved bruk av KCN -salter. CJP24 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Andre bruksområder
Noen andre bruksområder av kaliumcyanid er nevnt nedenfor.
- For den industrielle prosessen med herding nitrorasjonsstål (nitrogen tilsetning).
- For metallrengjøring.
- I utskrifts- og fotograferingsprosesser.
- Tidligere ble den brukt til utvinning av gull og sølv fra mineralene som inneholder dem, men så ble det erstattet av natriumnacn cyanid som er rimeligere, selv om det er like giftig.
- Som et insektmiddel for fumigering av trær, skip, jernbanebiler og lager.
- Som et reagens i analytisk kjemi, det vil si å gjøre kjemisk analyse.
- For å fremstille andre kjemiske forbindelser, for eksempel fargestoffer og fargestoffer.
 Gullutvinning i Sør -Afrika i 1903 ved hjelp av KCN hva som var i dødelig forurensning av det omgivende miljøet. Argyll, John Douglas Sutherland Campbell, hertug av, 1845-1914; Creswicke, Louis [ingen begrensninger]. Kilde: Wikimedia Commons.
Gullutvinning i Sør -Afrika i 1903 ved hjelp av KCN hva som var i dødelig forurensning av det omgivende miljøet. Argyll, John Douglas Sutherland Campbell, hertug av, 1845-1914; Creswicke, Louis [ingen begrensninger]. Kilde: Wikimedia Commons. Risiko
KCN er en veldig giftig forbindelse for dyr og de fleste planter og mikroorganismer. Er klassifisert som super giftig. Det er fremdeles dødelig i veldig små mengder.
Det kan tjene deg: Nikkelklorid (NICL2): Struktur, egenskaper, innhenting, brukDen skadelige effekten kan oppstå ved innånding, kontakt med hud eller øyne eller inntak. Hemmer mange metabolske prosesser, spesielt blodproteiner som deltar i oksygentransport som hemoglobin.
Det påvirker organene eller systemene som er mer følsomme for mangelen på oksygen, som sentralnervesystemet (hjernen), det kardiovaskulære systemet (hjerte- og blodkar) og lunger.
 Kaliumcyanid er en gift. Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay.
Kaliumcyanid er en gift. Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay. Virkningsmekanismen
KCN forstyrrer kroppens evne til å bruke oksygen.
Cyanidionet CN- av KCN har en stor tilhørighet til den jernfulle troen3+, Noe som betyr at når cyanid absorberer seg, reagerer det raskt med tro3+ Blod og vev.
På denne måten forhindrer det pusten av celler, som kommer inn i en tilstand av mangel på oksygen, for selv om de prøver å puste, kan de ikke bruke det.
Det forekommer da en forbigående tilstand av hipperapnea (pustende suspensjon) og hodepine, og til slutt død ved luftveisstans.
Ytterligere risikoer
Ved oppvarming produserer den veldig giftige gasser som HCN, nitrogenoksiderx, K -potassiumoksid2O og karbonmonoksid.
Ved kontakt med HCN -fuktighet som er svært brennbar og veldig giftig.
KCN er også veldig giftig for vannlevende organismer. Det skal aldri kastes til miljøet, da vannforurensning kan oppstå der de drikker dyr og bebor fisk.
Imidlertid er det bakterier som produserer cyanid som for eksempel Chromobacterium Violaceum og noen arter av Pseudomonas.
Nylige studier
Visse forskere fant at de grønne algene Chlorella vulgaris Det kan brukes til å behandle forurenset vann med KCN kaliumcyanid i lave konsentrasjoner.
Algene var i stand til å fjerne KCN effektivt, fordi dette i lave mengder stimulerte veksten av algene siden den aktiverte en intern mekanisme for å motstå toksisiteten til KCN.
Dette betyr at algene Chlorella vulgaris Det har potensial til å fjerne cyanid og at en effektiv metode for biologisk behandling av cyanidforurensning kan utformes med dette.
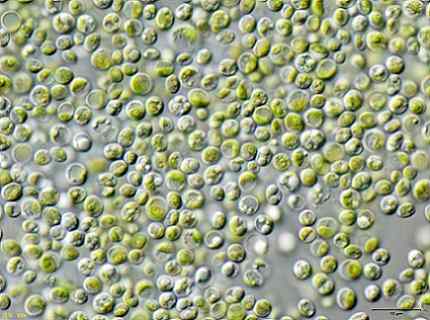 Algebilde Chlorella vulgaris observert i et mikroskop. JA: Bruker: neon / bruker: neon_ja [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Algebilde Chlorella vulgaris observert i et mikroskop. JA: Bruker: neon / bruker: neon_ja [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Referanser
- ELLER.S. National Library of Medicine. (2019). Kaliumcyanid. Nasjonalt senter for bioteknologiinformasjon. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Coppock, r.W. (2009). Trusler mot dyreliv av kjemiske krigføringsmidler. I håndbok for toksikologi av kjemiske krigføringsmidler. Gjenopprettet fra Scientedirect.com.
- Liu, q. (2017). Evaluering av fjerning av kaliumcyanid og dets toksisitet i grønne alger (Chlorella vulgaris). Bullmiljø forurenset toksikol. 2018; 100 (2): 228-233. NCBI kom seg.NLM.NIH.Gov.
- National Institute for Occupational Safety and Health (NIOSH). (2011). Kaliumcyanid: systemisk middel. CDC kom seg.Gov.
- Alvarado, l.J. et al. (2014). Riboswitch oppdagelse, struktur og funksjon. Syntese av uracil. I metoder i enzymologi. Gjenopprettet fra Scientedirect.com.
- « Natrium tripoliphosphate (Na5p3O10) struktur, egenskaper, bruksområder, påvirkning
- Fordi jeg er veldig søvnig? 9 årsaker og løsninger »

