Syklingsegenskaper, reaksjoner, bruksområder, eksempler
- 3370
- 1081
- Marius Aasen
De Cycloalcanos De er en familie av mettede hydrokarboner med en generell formel av CnH2n Det sammenfaller med alkenene; med forskjellen om at den tilsynelatende umettetheten ikke skyldes en dobbeltbinding, men på en ring eller syklus. Det er grunnen til at de regnes som alquenos -isomerer.
Disse dannes når lineære alkaner forener endene på kjedene sine for å stamme en lukket struktur. Som med alkanene, kan sykloalcanen utvise forskjellige størrelser, molekylære masser, substitusjoner eller til og med systemer sammensatt av mer enn en ring (polysyklikaler).
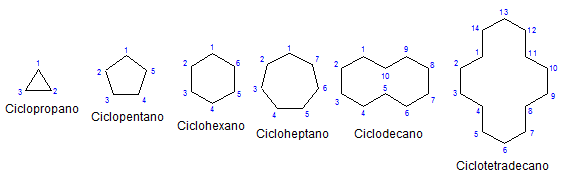
 Noen monocykliske cycloalcanos. Kilde: Mephisto Spa via Wikipedia.
Noen monocykliske cycloalcanos. Kilde: Mephisto Spa via Wikipedia. Av resten, kjemi og fysisk ligner de på alkanene. De har bare karbonatomer og hydrogener, de er nøytrale molekyler og samhandler derfor gjennom van der Walls -krefter. De fungerer også som drivstoff, og slipper varme når de brenner i nærvær av oksygen.
Hvorfor er Cycloalcanos mer ustabile enn deres kolleger med åpen kjede? Årsaken kan mistenkes ved å observere eksemplene på cycloalcanos representert i det øvre bildet: det er steriske (romlige) spenninger og hindringer.
Merk at jo mindre karbonatomer (oppført i blått), jo mer lukket er strukturen; Og det motsatte skjer når de øker, og blir som et halskjede.
Små sykloalcanos er gassformige, og når størrelsene øker sine intermolekylære krefter. Følgelig kan de være flytende i stand til å løse opp fett og apolar, smøremiddel eller faste stoffer som ser mørke farger og egenskaper som asfaltfarger.
[TOC]
Fysiske og kjemiske egenskaper
Polaritet
Når det bare er sammensatt av karbonatomer og hydrogener, atomer som ikke skiller seg for mye i elektronegativitet, gjør dette cycloalc -molekyler apolar og mangler derfor et dipolmoment.
De kan ikke samhandle gjennom dipol-dipolstyrker, men de er spesielt avhengige av Londons styrker, som er svake, men som øker med molekylmasse. Det er grunnen til at små sykloalcanos (med mindre enn fem karbonatomer) er gassformige.
Intermolekylære interaksjoner
På den annen side, siden de er ringer, har Cycloalcanos et større kontaktområde, som favoriserer Londons styrker blant molekylene sine. Dermed er de gruppert og samhandler bedre sammenlignet med alkaner; Og derfor er kokende og fusjonspunkter høyere.
Siden de har to mindre hydrogenatomer (CnH2n For cycloalcanos og cnH2n+2 For alkaner) er de lettere; Og legger til dette faktum av det største kontaktområdet, reduserer volumet som er okkupert av molekylene, og derfor er de tettere.
Metning
Hvorfor er cycloalcanos som mettede hydrokarboner klassifisert? Fordi de har hvordan de innlemmer et hydrogenmolekyl; Med mindre ringen åpnes, og i så fall ville de bli enkle alkaner. For at et hydrokarbon skal betraktes som mettet, må det ha maksimalt mulig antall C-H-koblinger.
Det kan tjene deg: Potentiometer (phameter)Stabilitet
Kjemisk ligner de veldig på alkaner. Begge har C-C- og C-H-koblinger, som ikke er så enkle å bryte for å forårsake andre produkter. Imidlertid er deres relative stabilitet forskjellig, som kan verifiseres eksperimentelt ved å måle forbrenningsvarmen (ΔHkam).
For eksempel sammenlignet ΔHkam For propan og cyclopropo (representert med en trekant i bildet) er det henholdsvis 527,4 kcal/mol og 498,9 kcal/mol.
Detaljene er at syklopropanenkam mindre (471 kcal/mol) fordi de er tre metylengrupper, CHO2; Men i virkeligheten frigjør den mer varme, og reflekterer ustabilitet større enn den estimerte. Denne overflødige energien sies at det skyldes spenninger inne i ringen.
Og faktisk styrer disse spenningene og differensierer reaktiviteten eller stabiliteten til cycloalcanos, med hensyn til alkaner, mot spesifikke reaksjoner. Så lenge spenningene ikke er veldig høye, har cycloalcanos en tendens til å være mer stabile enn deres respektive topper.
Nomenklatur
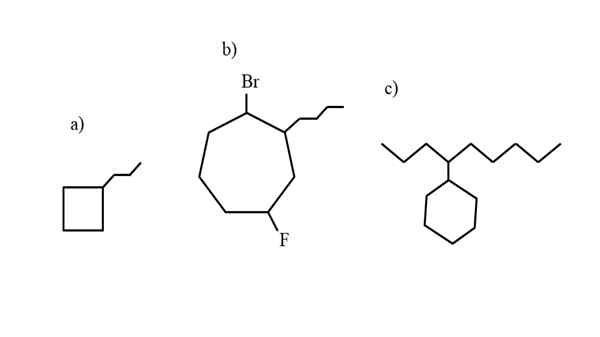 Noen eksempler på erstattet cycloalcan for å teste nomenklaturreglene. Kilde: Gabriel Bolívar.
Noen eksempler på erstattet cycloalcan for å teste nomenklaturreglene. Kilde: Gabriel Bolívar. Nomenklaturen styrt av IUPAC for cycloalcanos skiller seg ikke for mye enn alkanene. Den enkleste regelen av alle er å plassere sykkelprefikset- til navnet på alkanen som sykloalcano er dannet.
Dermed for eksempel av n-heksanen, cho3Ch2Ch2Ch2Ch2Ch3, Cyclohexan oppnås (representert med en sekskant i det første bildet). På samme måte skjer det med cyclopropane, cyclobutane, etc.
Nå kan disse forbindelsene lide substitusjoner fra et av deres hydrogener. Når antallet karbonatomer av ringen er høyere enn for leiebesetningene, blir ringen tatt som hovedkjeden; Dette er tilfelle av a) for det overlegne bildet.
Merk at i a) har syklobutanen (kvadratet) flere karbonatomer enn propilusgruppen knyttet til den; Så blir denne forbindelsen kalt propylciclobutano.
Hvis det er mer enn en substituent, bør de navngis i alfabetisk rekkefølge og på en slik måte at de har minst mulig lokaliseringsnummer. For eksempel kalles B): 1-Bromo-4-Fluoro-2-Butilcicloheptano (og ikke 1-Bromo-5-Fluoro-7-butylcicloheptano, som ville være feil).
Og til slutt, når den alquiliske substituenten har flere karbonatomer enn ringen, sies det da at sistnevnte er erstatningsgruppen i hovedkjeden. Dermed kalles c): 4-cyclohexilnonano.
Kan tjene deg: metalloksiderStruktur
Å legge de erstattede sykanerne til side, er det praktisk å fokusere bare på strukturelle baser: ringene. Disse var representert i det første bildet.
Når du observerer dem, kan den falske ideen oppstå at slike molekyler er flate; Men med unntak av Cyclopropo, er overflatene "Zigzagenantes", med karbonatomer som går ned eller laster opp i forhold til det samme planet.
Dette er fordi for å starte alle karbonatomer har SP -hybridisering3, og presenterer derfor tetraedriske geometrier med 109,5º koblingsvinkler. Men hvis geometrien til ringene blir nøye observert, er det umulig for deres vinkler å være; For eksempel er vinklene i cyklopropan -trekanten 60º.
Dette er det som kalles vinkelspenning. Jo større ringene, vinkelen mellom C-C-koblingene er nærmere 109,5º, noe som forårsaker en reduksjon i slik spenning og en økning i stabiliteten for sykloalcan.
Et annet eksempel blir observert i syklobutanen, hvis koblingsvinkler er 90º. Allerede i Cyclopentano er dets vinklene 108º, og fra cycloheksanen sies det da at vinkelspenningen slutter å utøve en slik bemerkningseffekt så bemerket.
Konformasjoner
I tillegg til vinkelspenning, er det andre faktorer som bidrar til spenningen som cycloalcanos opplever opplever.
C-C-koblinger kan ikke rotere uten mer, siden dette vil innebære at hele strukturen "gyser". Dermed kan disse molekylene ta i bruk meget veldefinerte romlige konformasjoner. Hensikten med disse bevegelsene er å redusere spenningene forårsaket i formørkelsen av hydrogenatomer; det vil si når den ene foran den andre.
For eksempel ligner konformasjoner for syklobutan en sommerfugl som slår vingene; de fra Cyclopentano, en konvolutt; De av sykloheksanen, en båt eller stol, og jo større ringen, jo større er antall og former de kan adoptere i verdensrommet.
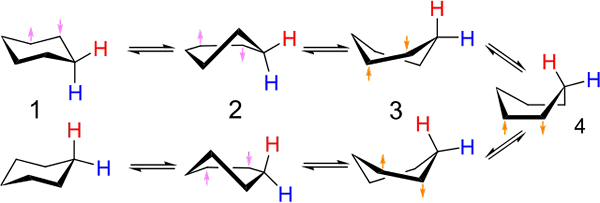 Investeringer mellom stol og båttype konformasjon for sykloheksanen. Kilde: Kministi [CC0].
Investeringer mellom stol og båttype konformasjon for sykloheksanen. Kilde: Kministi [CC0]. Det overlegne bildet viser et eksempel på slike konformasjoner for sykloheksanen. Merk at den påståtte flate sekskanten virkelig virker mer som en stol (til venstre for bildet) eller en båt (til høyre). Et hydrogen er representert med røde tekster, og en annen med blå tekster, for å indikere hvordan deres relative posisjoner endres etter investeringer.
I (1), når hydrogen er vinkelrett på ringplanet, sies det at det er i aksial stilling; Og når det er parallelt med dette, sies det at det er i ekvatorialposisjon.
Reaksjoner
Reaksjonene som cykloalcan kan lide er de samme som for alkaner. Begge brenner i nærvær av et overflødig oksygen i de typiske forbrenningsreaksjonene for å produsere karbondioksid og vann. På samme måte kan begge lide halogenasjoner, der et hydrogen erstattes av et halogenatom (F, CL, BR, I).
Det kan tjene deg: Fordeler og ulemper ved helsekjemi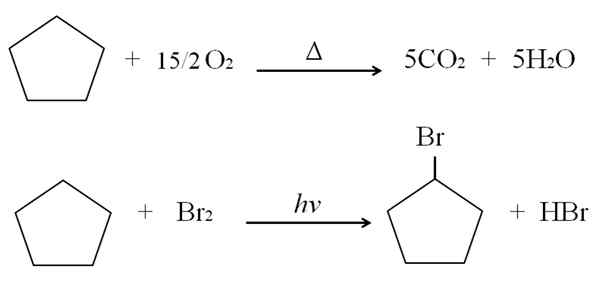 Cyclopentano -reaksjoner. Kilde: Gabriel Bolívar.
Cyclopentano -reaksjoner. Kilde: Gabriel Bolívar. Over forbrennings- og halogeneringsreaksjoner for cyclopentano vises som et eksempel. En føflekk brenner i nærvær av varme og 7,5 mol molekylært oksygen for å bryte ned i CO2 og h2ENTEN. På den annen side, i nærvær av ultrafiolett og brome.
applikasjoner
Bruken av cycloalcanos avhenger i stor grad av antall karbonatomer. Den letteste, og derfor gassformige, en gang tjente til å mate gasslampene med offentlige lys.
Væsker har i mellomtiden fortjeneste som løsningsmidler av oljer, fett eller kommersielle produkter av apolar karakter. Blant disse kan du nevne Cyclopentano, Cyclohexan og Cycloheptan. På samme måte brukes de ofte i rutinemessige operasjoner i Petróleos laboratorier, eller i drivstoffformulering.
Hvis de er tyngre, kan de brukes som smøremidler. På den annen side kan de også representere startmaterialet for medikamentsyntese; Som karboplatin, som inkluderer i sin struktur en cyclobutan -ring.
Cychannel -eksempler
Til slutt blir den returnert til begynnelsen av artikkelen: bildet med flere ikke -berettigede sykloalcanos.
For å huske cycloalcanos, er det nok å tenke på de geometriske figurene: trekant (cyclopropane), firkant (cyclobutane), pentagon (cyclopentano), sekskant.
Jo større ringen, jo mindre ligner den sin respektive geometriske figur. Det har allerede blitt sett at sykloheksanen er alt annet enn en sekskant; Det samme skjer tydeligere med Cyclootetradecano (fjorten karbonatomer).
Et poeng kommer der de vil oppføre seg som halskjeder som kan brettes for å redusere spenningene på koblingene og formørkelsene sine til fulle.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Kjemi librettexts. (2. juni 2019). Navngi cycloalkanes. Gjenopprettet fra: Chem.Librettexts.org
- Wikipedia. (2019). Cycloalkane. Hentet fra: i.Wikipedia.org
- Clark Jim. (2015). Vi introduserer alkaer og sykloalkaner. Gjenopprettet fra: Chemguide.co.Storbritannia
- James Ashenhurst. (2019). Konformasjoner og cycloalkanes. Master Organic Chemistry. Gjenopprettet fra: MasterorganicChemistry.com
- Fernández Germán. (s.F.). Cycloalcanos-Toria. Organisk kjemi. Gjenopprettet fra: Chemicicaorganica.org

