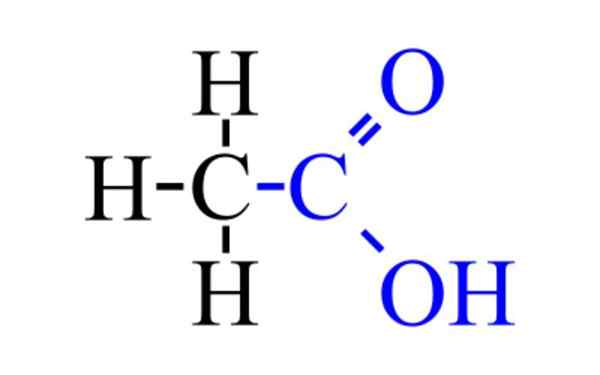
Eddiksyre (CH3COOH)
- 949
- 177
- Anders Mathisen
 Eddiksyre er ansvarlig for den karakteristiske smaken og lukten av eddik
Eddiksyre er ansvarlig for den karakteristiske smaken og lukten av eddik Hva er eddiksyre?
Han eddiksyre, o Estansyre, det er en fargeløs organisk væske hvis kjemiske formel er CHO3COOH. Det er til stede i eddik, som gir sin karakteristiske lukt og smak. Eddik er en vandig eddiksyreoppløsning med en 5%konsentrasjon, omtrent.
Som navnet indikerer, er det en syreforbindelse, og derfor har eddik pH -verdier mindre enn 7. I nærvær av dets acetatsalt utgjør et effektivt dempesystem i reguleringen av pH mellom 2,76 og 6,76, det vil si at det opprettholder pH i det intervallet mot moderat tilsetning av en base eller en syre.
Etter maursyre, er HCOOH, en av de enkleste organiske syrene, som også representerer sluttpunktet for mange gjæringsprosesser. Det brukes ofte til å kle mat og også eliminere urenheter og mikroorganismer fra grønnsaker.
Historie
Mennesket har brukt gjæring av mange frukt, belgfrukter, frokostblandinger osv., For å få alkoholholdige drikker, produkt av transformasjon av sukker, som glukose, i etanol, CH3Ch2Åh.
Sannsynligvis fordi den første metoden for alkohol- og eddikproduksjon er gjæring, kanskje prøver å produsere alkohol i et ubestemt øyeblikk, for mange århundrer siden, ble eddik oppnådd ved en feiltakelse.
Allerede i det tredje århundre til.C., Den greske filosofen Theophastus beskrev virkningen av eddik på metaller for pigmenterproduksjon, for eksempel blyhvit.
1800
I 1823 ble et tårnformet utstyr designet i Tyskland for aerob gjæring av forskjellige produkter, for å oppnå eddiksyre i form av eddik.
I 1846 oppnådde Herman Foelbe for første gang syntesen av eddiksyre gjennom bruk av uorganiske forbindelser. Syntesen begynte med klorering av karbondisulfid og konkluderte, etter to reaksjoner, med en elektrolytisk reduksjon til eddiksyre.
På slutten av det 19. og begynnelsen av det tjuende århundre, på grunn av J J. Weizmann begynte å bruke bakteriene Clostridium acetobutylicum For eddiksyreproduksjon, gjennom anaerob gjæring.
Det kan tjene deg: Forhold mellom kjemi og teknologi med menneske, helse og miljø1900
På begynnelsen av 1900 -tallet var den dominerende teknologien produksjon av eddiksyre ved oksidasjon av acetaldehyd.
I 1925 designet Henry Dreyfus, av det britiske selskapet Celanese, et pilotanlegg for metanol karbonisering. Deretter introduserte det tyske selskapet BASF i 1963 bruken av kobolt som katalysator.
Otto Hromatka og Heinrich Ebner (1949), designet en tank med et luftopprør og forsyningssystem for aerob gjæring, beregnet på eddikproduksjon. Dette implementeringen, med noen tilpasninger, forblir i bruk.
I 1970 brukte det nordamerikanske selskapet Monsanto et system med katalysatorer basert på rhodium for metanol karbonilatelse.
Deretter introduserer BP -selskapet i 1990, Cativa -prosedyren med bruk av iridiumkatalysatoren for samme formål. Denne metoden viste seg å være mer effektiv og mindre miljømessig aggressiv enn Monsanto -metoden.
Eddiksyrestruktur
 Kjemisk eddiksyrestruktur
Kjemisk eddiksyrestruktur Det øvre bildet viser strukturen til eddiksyre representert med en modell av kuler og søyler. De røde kulene tilsvarer oksygenatomene, som igjen tilhører karboksylgruppen, -COOH. Derfor er det en karboksylsyre. På høyre side av strukturen har du metylgruppen, -CH3.
Som det kan sees, er det et veldig lite og enkelt molekyl. Den har et permanent dipolmoment på grunn av -COOH -gruppen, som også lar eddiksyre danne to etter hverandre hydrogenbroer.
Det er disse broene som romlig leder molekylene til CH3COOH for å danne bonter i flytende tilstand (og gass).
 To hydrogenbroer
To hydrogenbroer Opp i bildet blir det observert hvordan de to molekylene er anordnet for å danne de to hydrogenbroene: O-H-O og O-H-O.
For å fordampe eddiksyre, må nok energi tilføres for å bryte disse interaksjonene, og det er derfor det er en væske med et kokepunkt større enn vannet (ca. 118 ° C).
Fysiske og kjemiske egenskaper ved eddiksyre
Kjemiske navn
Syre:
Kan tjene deg: aluminiumbromid- Eddik
- Etanoisk
- Etyl
Molekylær formel
C2H4ENTEN2 eller Ch3COOH.
Fysisk utseende
Fargeløs væske.
Lukt
Karakteristisk dekar.
Smak
Brenne.
Kokepunkt
244 ºF ved 760 mmHg (117,9 ºC).
Smeltepunkt
61,9 ºF (16,6 ºC).
tenningspunkt
112 ºF (åpent glass) 104 ºF (lukket glass).
Vannløselighet
106 mg/ml ved 25 ºC (det er blandbar i alle proporsjoner).
Løselighet i organiske løsningsmidler
Det er løselig i etanol, etyleter, aceton og benzen. Det er også løselig i karbontetraklorid.
Tetthet
1.051 g/cm3 ved 68 ºF (1 044 g/cm3 ved 25 ºC).
Damptetthet
2.07 (med luftforhold = 1).
Damptrykk
15,7 mmHg ved 25 ºC.
Nedbrytning
Når den blir oppvarmet til mer enn 440 ºC, brytes det ned for å produsere karbondioksid og metan.
Goo
1.056 mpascal ved 25 ° C.
Korrosivitet
Glacial eddiksyre er sterkt etsende og inntaket kan forårsake alvorlige spiserør og pyloruslesjoner hos mennesker.
Forbrenningsvarme
874.2 kJ/mol.
Fordampningsvarme
23,70 kJ/mol ved 117,9 ºC.
23,36 kJ/mol ved 25,0 ºC.
Ph
- En konsentrasjonsløsning på 1 m har en pH på 2,4.
- For en 0,1 m løsning er pH 2,9.
- Og 3.4 Hvis løsningen er 0,01m.
Overflatespenning
27,10 mn/m a 25 ºC.
Pka
4.76 til 25 ºC.
Kjemiske reaksjoner
Eddiksyre er etsende for mange metaller, og frigjør gass h2 og dannende metallsalter som kalles acetater. Med unntak av kromacetat (II) er acetater oppløselige i vann.
Hans reaksjon med magnesium er representert med følgende kjemiske ligning:
MG (S) +2 CHO3COOH (AG) => (CH3Coo)2Mg (Ag) +H2 (g)
Ved reduksjon danner eddiksyre etanol. Du kan også danne eddisk anhydrid på grunn av vanntap av to vannmolekyler.
Eddiksyre bruker
Industriister
- Eddiksyre reagerer med etylen i nærvær av oksygen for å danne vinylacetatmonomeren, ved bruk av paladium som en katalysator for reaksjonen. Polymeriza vinylacetat i polyvinylacetat, som brukes som en komponent av malerier og limmateriale.
- Reagerer med forskjellige alkoholer for produksjon av estere, inkludert etylacetat og propylacetat. Acetatestere brukes som blekkløsningsmidler, nitrocellulose, belegg, lakker og akryllacas.
Kan tjene deg: legering- Ved å kondensere to eddiksyremolekyler dannes eddikanhydrid, CH3Co-o-coch3. Denne forbindelsen griper inn i syntesen av celluloseacetat, en polymer som utgjør et syntetisk stoff og brukes i utdyping av fotografiske filmer.
Som et løsningsmiddel
- Det er et polært løsningsmiddel som er i stand til å løse opp polare forbindelser som uorganiske salter og sukker, men også løser opp ikke -polare forbindelser, for eksempel oljer og fett. I tillegg er eddiksyre blandbar med polare og ikke -polare løsningsmidler.
- Umvilheten av eddiksyre i alkanene avhenger av forlengelsen av kjeden til disse: Når lengden på strengen av alkaner økes, reduseres dens blandbarhet med eddiksyre.
Leger
- Fortynnet eddiksyre brukes som et antiseptisk middel, påført lokalt, med evnen til å angripe bakterier som streptokokker, stafylokokker og pseudomonas. På grunn av denne handlingen brukes den i behandlingen av hudinfeksjoner.
- Det brukes i endoskopien til Barrett spiserør, en tilstand der spiserøret belegg er modifisert, og blir lik tynntarmenes spalte.
- En 3% eddiksyregel ser ut til å være et effektivt adjuvans for behandling med vaginal misoprostol -medikament, noe.
- Det brukes som erstatning for kjemisk peeling. Imidlertid har det dukket opp komplikasjoner med denne bruken.
- Det brukes som fargestoff for å oppdage humant papillomavirus (HPV).
I mat
Eddik har blitt brukt som krydder og smakstilsetning av mat i århundrer, så dette er den mest kjente påføringen av eddiksyre.
Referanser
- Hva er etansyre? Gjenopprettet fra Byjus.com
- EDDIKSYRE. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov
- Eddiksyre Glacial. Gjenopprettet fra ChemicalBook.com

