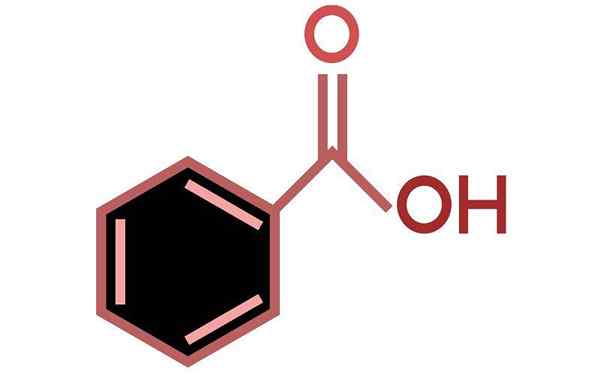
Benzosyre (C6H5COOH)
- 3575
- 502
- Prof. Joakim Johansen
 Benzosyre er en aromatisk karboksylsyre
Benzosyre er en aromatisk karboksylsyre Hva er benzosyre?
Han Benzosyre Det er den enkleste aromatiske syre av alle, som har som molekylær formel C6H5COOH. I naturen finnes det i mange planter, spesielt i frukt som aprikos og blåbær. Det forekommer også i bakterier som et biprodukt av aminosyrefenylalaninmetabolisme.
Det genereres i tarmen ved den bakterielle (oksidative) behandlingen av polyfenolene som er til stede i noen matvarer.
C6H5COOH er, i motsetning til mange syrer, en fast forbindelse, bestående av lys, hvite og filiformkrystaller, som gir fra seg en mandel og karakteristisk aroma.
En av hovedfunksjonene til benzosyre er å hemme veksten av gjær, mugg og noen bakterier, så den brukes som matbeskyttelsesmiddel.
Selv om det ikke er en spesielt giftig forbindelse, har den noen skadelige handlinger for helse. Derfor, som anbefaler en maksimal inntaksdose på 5 mg/kg kroppsvekt/dag, tilsvarer et daglig inntak på 300 mg benzosyre.
Benzosyrestruktur
 Benzosyrestruktur. Kilde: Wikimedia Commons
Benzosyrestruktur. Kilde: Wikimedia Commons Det overordnede bildet representerer strukturen til benzosyre i en bar og sfærermodell.
Hvis antallet svarte kuler telles, vil det bli bekreftet at det er seks av dem, det vil si seks karbonatomer, to røde kuler tilsvarer de to oksygenatomer i karboksylgruppen, -COOH, og til slutt de hvite kulene er hydrogenatomer.
På venstre side har du den aromatiske ringen, hvis aromatisitet er illustrert med de diskontinuerlige linjene i midten av ringen. Og til høyre, -COOH -gruppen, ansvarlig for syreegenskapene til denne forbindelsen.
Molekylært, C6H5COOH har en flat struktur, fordi alle atomer (bortsett fra hydrogener) har SP -hybridisering2.
På den annen side tillater -COOH -gruppen, svært polar, en permanent dipol å eksistere i strukturen.
Dette faktum resulterer i C6H5Cooh kan samhandle med seg selv gjennom dipol-dipolo-styrker. Spesielt med spesielle hydrogenbroer.
Hvis gruppen -COOH observeres, vil det bli funnet at oksygenet til C = O kan godta en hydrogenbro, mens O -H oksygen donerer dem.
Krystall- og hydrogenbroer
Benzosyre kan danne to hydrogenbroer: mottar og aksepterer en samtidig. Derfor danner det Dímeros, det vil si at molekylet er "relatert" med et annet.
Dette er par eller dimerer, C6H5Cooh-Hoocc6H5, det strukturelle grunnlaget som definerer det faste som følge av planleggingen i verdensrommet.
Kan tjene deg: Diatomiske elementerFysiske og kjemiske egenskaper ved benzosyre
Kjemiske navn
Syre:
-Benzoic
-Benzenocarboxylic
-Dracyl
-Karboksibenzen
-Benzenoforemisk
Molekylær formel
C7H6ENTEN2 eller c6H5COOH
Molekylær vekt
122,123 g/mol.
Fysisk beskrivelse
Fast eller i form av krystaller, vanligvis hvitt, men kan presentere en beige farge hvis den huser visse urenheter. Krystallene hans er ordning eller nålformet.
Lukt
Det lukter mandler og er fint.
Smak
Smakløs eller litt bitter. Smaksdeteksjonsgrensen er 85 ppm.
Kokepunkt
480º F A 760 mmHg (249 ºC).
Smeltepunkt
252,3º F (121,5-123,5 ºC).
tenningspunkt
250º F (121 ºC).
Sublimering
Kan sublimisere fra 100 ºC.
Vannløselighet
3,4 g/l a 25 ºC.
Løselighet i organiske løsningsmidler
- 1 g benzosyre løses opp i et volum lik: 2,3 ml kald alkohol, 4,5 ml kloroform, 3 ml eter, 3 ml aceton, 30 ml karbondetraklorid, 10 ml benzen, 30 ml karbondisulfid, og 2,3 ml Treemolje.
- Det er også løselig i flyktige og faste oljer.
- Den er litt løselig i oljeeter.
- Hans løselighet i Hexano er 0,9 g/l, i metanol 71,5 g/l, og i toluen 10,6 g/l.
Tetthet
1,316 g/ml ved 82,4º F, og 1 2659 g/ml ved 15 ° C.
Damptetthet
4,21 (med luftforhold tatt som referanse = 1)
Damptrykk
1 mmHg ved 205 º F og 7,0 x 10-4 MMHG ved 25 ºC.
Stabilitet
En løsning med en konsentrasjon på 0,1% i vann er stabil i minst 8 uker.
Nedbrytning
Det dekomponerer ved oppvarming, avgir en dekar og irriterende røyk.
Goo
1.26 CPOISE ved 130 ºC.
Forbrenningsvarme
3227 kJ / mol.
Fordampningsvarme
534 kJ /mol ved 249 ºC.
Ph
Rundt 4 i vann.
Overflatespenning
31 N/M A 130 ºC.
Pka
4.19 til 25 ºC.
Brytningsindeks
1.504-1,5397 (ηd) ved 20 ºC.
Reaksjoner
- I kontakt med basene (NaOH, KOH, etc.) Dann Benzoat Sales. For eksempel, hvis du reagerer med NaOH, natriumbenzoatform, C6H5Sti.
- Reagerer med alkoholer for å danne estere. For eksempel stammer reaksjonen på etylalkohol etylesteren. Noen benzosyreestere oppfyller funksjon som myknere.
- Reagerer med fosforpentaklorid, PCL5, For å danne Benzoils klorid, et syrehalogenid. Benzoilklorid kan reagere med ammonium (NH3) eller et amin som metylamin (Cho3NH2) For å danne benzamid.
- Reaksjonen av benzosyre med svovelsyre produserer sulfonering av den aromatiske ringen. Den funksjonelle gruppen -så3H erstatter et hydrogenatom i målposisjonen til ringen.
Det kan tjene deg: First Chemistry Revolution- Den kan reagere med salpetersyre, med bruk av svovelsyre som en katalysator, og danner meta-nitrobenzoinsyre.
- I nærvær av en katalysator, for eksempel jernklorid, FECL3, Benzosyre reagerer med halogener. For eksempel reagerer den med klor for dannelse av metaklorbenzosyre.
Produksjon
Noen produksjonsmetoder for denne forbindelsen:
- Det meste av benzosyre oppstår industrielt ved å oksidere toluen med oksygenet som er til stede i luften. Prosessen katalyseres av koboltbensin, ved en temperatur på 140-160 ºC og ved et trykk 0,2-0,3 MPa.
- Toluen kan klorinere for å produsere benzotricloride, som deretter hydrolyseres med benzosyre.
- Benzonitril og benzamidhydrolyse, i et surt eller alkalisk medium, kan forårsake benzosyre og dets konjugerte baser.
- Benzylalkohol i en oksidasjon mediert av kaliumpermanganat, i et vandig medium, produserer benzosyre. Reaksjonen skjer ved oppvarming eller refluksdestillasjon. Når prosessen er fullført, filtreres blandingen for å fjerne mangandioksid, mens supernatanten er avkjølt for å oppnå benzosyre.
- Benzoktikloridforbindelsen reagerer med kalsiumhydroksyd, ved bruk av jern- eller jernsalter som katalysatorer, og danner opprinnelig kalsiumbenzoat, CA (C (C6H5Coo)2. Deretter omdannes dette saltet, ved reaksjon med saltsyre, omdannet til benzosyre.
Benzosyre bruker
Industriister
- Det brukes i produksjonen av fenol ved oksidativ dekarboksylering av benzosyre ved temperaturer på 300-400 ºC, fordi fenol kan brukes i syntesen av nylon.
- Fra den benzoatglykol, kjemisk forløper for esterdietylenglykol og trietylenglykolesteren, stoffer som brukes som myknere. Kanskje den viktigste anvendelsen av myknere er limformuleringer. Noen lange kjedeestere brukes til å myke plast som PVC.
- Det brukes som en aktivator av gummipolymerisasjon. I tillegg er det en mellomledd i produksjonen av alquidiske harpikser, samt tilsetningsstoffer for applikasjoner i utvinning av råolje.
- I tillegg brukes det i utdyping av harpikser, fargestoffer, fibre, plantevernmidler og som et modifiserende middel for polyamidharpiksen for polyesterproduksjon. Det brukes til vedlikehold av tobakksaroma.
Kan tjene deg: binære salter- Det er en forløper for Benzoils klorid, som er et startmateriale for syntese av forbindelser som benzylbenzoat, brukt i utdyping av kunstige smaker og insekter av insekter.
Medisin
- Det er en komponent av Whitfield -salien. Denne salven er sammensatt av 6% av benzosyre og 3% salisylsyre.
- Det er en ingrediens i benzoin -skjæret, brukt som inhalerende aktuell og dekongestant antiseptisk. Det ble brukt som en forventningsfull, smertestillende og antiseptisk til begynnelsen av 1900 -tallet.
- Benzosyre har blitt brukt i eksperimentell terapi av pasienter med gjenværende nitrogenakkumuleringssykdommer.
Matbevaring
- Benzosyre og salter brukes i matbevaring. Forbindelsen er i stand til å hemme veksten av mugg, gjær og bakterier, gjennom en pH -avhengig mekanisme.
Upraktisk
Kan reagere med askorbinsyre (C -vitamin) som er til stede i noen drinker, og produserer benzen, kreftfremkallende forbindelse. På grunn av dette søkes andre forbindelser med evnen til å spare mat som ikke presenterer problemene med benzosyre.
Andre
- Den brukes i en aktiv emballasje, å være til stede i ionomerer. Fra dem frigjøres benzosyre, i stand til å hemme veksten av slektsarter Penicillium og Aspergillus I mikrobielle medier.
- Det brukes som et konserveringsmiddel for frukt- og parfymesaftaromaen.
- Benzosyre brukes som et selektivt ugressmiddel for å kontrollere ugress med brede og gress i soyabønner, agurker, meloner, peanøtter og treholdige prydplanter.
Toksisitet
- I kontakt med huden og øynene kan den produsere rødhet. Ved innånding kan forårsake irritasjon av luftveiene og hoste. Inntak av store mengder benzosyre kan forårsake gastrointestinale lidelser, og kunne nå lever- og nyreskade.
- Benzosyre og benzoater kan frigjøre histamin som kan forårsake allergiske reaksjoner og irritasjon av øyne, hud og slimhinner.
- Det mangler kumulativ, mutagen eller kreftfremkallende effekt, siden den raskt absorberes i tarmen, og eliminerer i urinen uten å samle seg i kroppen.
- Den maksimale tillatte dosen i henhold til WHO er 5 mg/kg kroppsvekt/dag, omtrent 300 mg/dag. Akutt toksisitetsdose hos mennesker: 500 mg/kg.
Referanser
- Benzosyre. Gjenopprettet fra ChemicalBook.com
- Benzosyre. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov
- Benzosyre. Innhentet fra.Wikipedia.org

