Boric acid kjemisk struktur, egenskaper, preparat, bruker

- 2509
- 407
- Marius Aasen
Han borsyre Det er en uorganisk forbindelse hvis kjemiske formel er h3Bo3. Det består av et hvitt eller fargeløst fast stoff. Det er en svak syre som i vandig oppløsning produserer, avhengig av dens konsentrasjon, en pH mellom 3,8 og 4,8. Det er lite løselig i kaldt og moderat oppløselig varmt vann.
Borsyren ble oppdaget i 1702 av Wilhelm Man.
 Fast prøve av borsyre på klokke glass. Kilde: Walkerma via Wikipedia.
Fast prøve av borsyre på klokke glass. Kilde: Walkerma via Wikipedia. Imidlertid påpekes det også at Boerg fremstilte borsyren ved å tilsette vann til boraksen og varme opp løsningen for å fordampe den, og dermed etterlater sedimentet kryalsyrekrystaller.
Denne syren er en veldig nyttig forbindelse som har mange anvendelser innen industri og medisin, og brukes også som et insektmiddel, bevaring av tre, forsinkende brann og er en bestanddel av en pH -dempingsløsning.
[TOC]
Kjemisk struktur
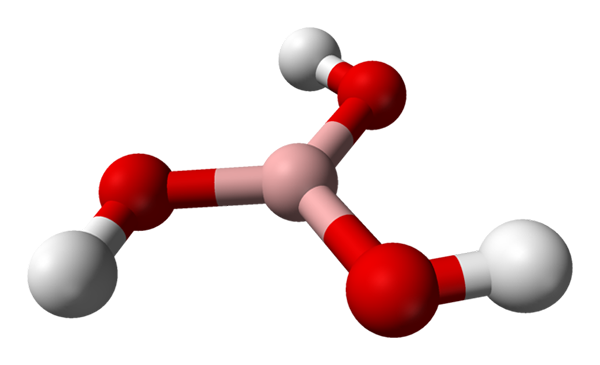 Borsyremolekyl representert med en kuler og bar -modell. Kilde: Benjah-BMM27 [Public Domain]
Borsyremolekyl representert med en kuler og bar -modell. Kilde: Benjah-BMM27 [Public Domain] I det overordnede bildet har vi molekylet i h selv3Bo3. Legg merke til at hydrogenatomer, representert av hvite kuler, ikke er knyttet til det sentrale boratom, som det kan antyde den kjemiske formelen; men snarere til oksygenatomer, representert med røde kuler.
Dermed er en mer praktisk formel, selv om den er mindre brukt, for borsyre B (OH)3, som indikerer at surheten deres skyldes H -ioner+ Frigjort fra OH -gruppene sine. Molecula B (OH)3 Den har en trigonal flat geometri, med sitt boratom som har en kjemisk hybridisering SP2.
B (OH)3 Det er et kovalent høyt molekyl, siden forskjellen i elektronegativitet mellom boratom og oksygen ikke er veldig stor; Så B-O-koblingene er i hovedsak kovalent. Merk at strukturen til dette molekylet ligner en spinner. Kan jeg slå på din egen akse på samme måte?
Krystaller
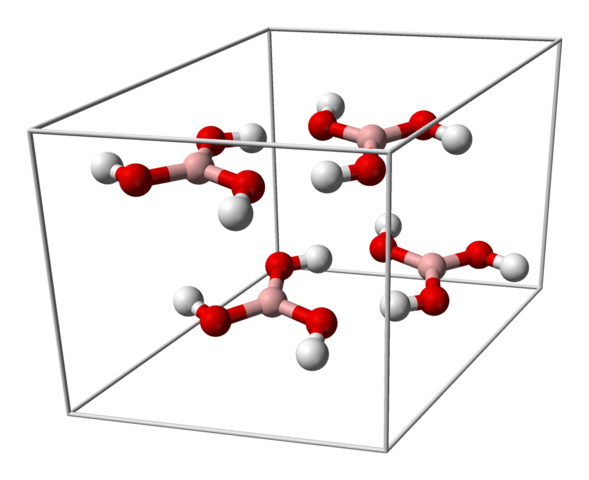 Unitary Cell for H3BO3 Crystal. Kilde: Benjah-BMM27 [Public Domain]
Unitary Cell for H3BO3 Crystal. Kilde: Benjah-BMM27 [Public Domain] Det øvre bildet viser den enhetlige cellen som tilsvarer den treholdige krystallinske strukturen for borsyre som under visse syntese forhold kan ta i bruk den kompakte sekskantede strukturen. Merk at det er fire molekyler per enhetlig celle, og som er bestilt i to lag, A og B, vekslet (de er ikke overlagret oppå hverandre).
På grunn av symmetri og veiledning av B-OH-koblinger, kan det antas at B (OH)3 Det er apolar; Imidlertid endrer eksistensen av intermolekylære hydrogenbroer historien. Hvert B (OH) molekyl3 å gi eller motta tre av disse broene, med totalt seks dipol-dipolo-interaksjoner, slik som de som er observert på bildet nedenfor:
Kan tjene deg: terpenos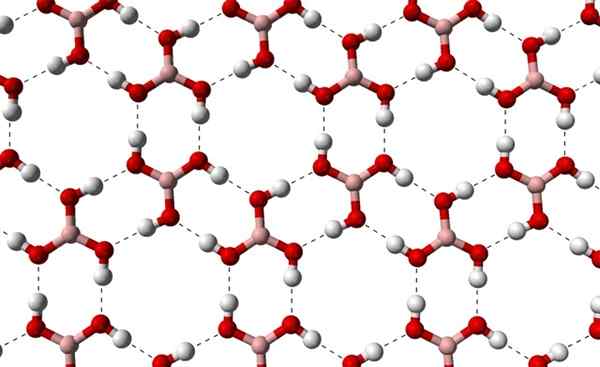 Krystallinske lag med H3BO3 observert fra en høyere akse. Kilde: Benjah-BMM27 [Public Domain]
Krystallinske lag med H3BO3 observert fra en høyere akse. Kilde: Benjah-BMM27 [Public Domain] Legg merke til at disse hydrogenbroene er de retningsbestemte interaksjonene som styrer borsyrekrystaller, og etablerer mønstre av prydaspekter; Interne ringer kanskje med tilstrekkelig plass til å okkludere noen urenheter som ikke er i krystallinske defekter.
Disse hydrogenbroene, til tross for den lave molekylmassen til B (OH)3, De holder glasset sammenhengende nok til at han trenger en temperatur på 171 ºC for å smelte. Det er ukjent hvilke effekter som vil ha høyt trykk (i rekkefølgen av GPA) på molekylære lag av B (OH)3.
Egenskaper
Navn
Iupac: borsyre og trihydrooxidobor. Andre navn: Ortoborsyre, Borracic Acid, Sassolite, Borofax og Trihydroxiborano.
Molmasse
61,83 g/mol
Fysisk utseende
Krystallinsk, fargeløs og gjennomsiktig hvitt fast stoff. Det oppnås også som granuler eller i form av hvitt støv. Litt uklar å berøre.
Lukt
Toalett
Smak
Litt bitter
Smeltepunkt
170,9 ºC
Kokepunkt
300 ºC
Vannløselighet
Moderat løselig i kaldt og oppløselig vann i varmt vann:
2,52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
Borsyre er delvis oppløselig i vann og har en tendens til å synke inn i den. Denne løseligheten har en tendens til å øke i nærvær av syrer, for eksempel hydroklor, sitron og tartarisk.
Løselighet i andre løsningsmidler
-Glyserol: 17,5 % ved 25 ° C
-Etylenglykol: 18,5 % ved 25 ° C
-Aceton: 0,6 % ved 25 ° C
-Etylacetat: 1,5 % ved 25 ° C
-Metanol: 172 g/l a 25 ºC
-Etanol: 94,4 g/l a 25 ºC
Oktanol/vannpartisjonskoeffisient
Logg P = -0.29
Surhet (PKA)
9.24. 12.4. 13.3. Dette er de tre konstantene av deres respektive dissosiasjoner for å frigjøre h+ I vann.
Ph
3,8 - 4,8 (3,3 % i vandig løsning)
5.1 (0.1 molar)
Damptrykk
1.6 · 10-6 MMHG
Stabilitet
Stabil i vann
Nedbrytning
Det brytes sammen når den varmes opp over 100 ºC, og danner borisk anhydrid og vann.
Reaktivitet
Borsyre danner oppløselige salter med monovalente kationer, for eksempel: NA2B4ENTEN7.10H2Eller, og uoppløselige salter med divalente kationer, førerhus4ENTEN7.6H2ENTEN.
I vandig løsning produserer den en syreoppløsning, og tenker at denne egenskapen skyldtes subtraksjon av OH -grupper- av vannet. Borsyre er kvalifisert som en svak syre av Lewis -typen.
Borsyre reagerer med glyserol og mannitol, og øker surheten i det vandige miljøet. PKA er modifisert fra 9,2 til 5, på grunn av dannelsen av boro-manitol Quelato [BC6H8ENTEN2(ÅH)2]-, som frigjør h+.
Forberedelse
Borsyre er i fri tilstand i vulkanutslipp i regioner som Toscana of Italy, Lipari Islands og i staten Nevada, USA. Det finnes også i mineraler som Borax, Boracita, Ulexita og Colemanita.
Kan tjene deg: halogenerBorsyre er hovedsakelig fremstilt ved reaksjonen av boraksmineralet (natriumnatrium tetorat) med mineralsyrer, så som saltsyre, svovelsyre, etc.
Na2B4ENTEN9· 10H2O +HCl => 4 H3Bo3 + 2 NaCl +5 H2ENTEN
Det tilberedes også gjennom hydrolyse av Boro og Diborano Trihaluro.
Borsyre er fremstilt fra kollemanitt (CA2B6ENTENelleve· 6 H2ENTEN). Prosedyren består i behandlingen av mineral med svovelsyre for å løse opp borforbindelser.
Deretter er løsningen der borsyren til de avviklede fragmentene er til stede separert. Hydrogensulfidløsningen behandles for å utfelle urenhetene til arsen og jern. Supernatanten avkjøles for å produsere et bunnfall av borsyre og skille den fra suspensjonen.
applikasjoner
I bransjen
Borsyre brukes i glassfiberutdyping. Ved å bidra til å redusere smeltepunktet, øker det styrken og effektiviteten til tekstil glassfiber: materiale som brukes til å forsterke plasten som brukes i kar, industrielle rør og datakretser plater.
Borsyre deltar i produksjonen av borosilisert glass, som tillater å skaffe et glassbestandig glass, brukbar i husholdningens kjøkken, i glassmaterialet til laboratorier, lysrør, fiberoptisk, LCD -skjermer osv.
Det brukes i metallurgisk industri for å herde og behandle stållegeringer, samt favorisere metallforing av materialer.
Det brukes som en kjemisk komponent i hydraulisk brudd (fracking): Metode brukt i olje- og gassekstraksjon. Borsyre fungerer som et brannhemmende middel i cellulosematerialer, plast og tekstiler som er impregnert med borsyre for å øke brannmotstanden.
I medisin
Borsyre brukes fortynnet i øyevask. Borsyre gelatinkapsler brukes til behandling av soppinfeksjoner, spesielt Candida albicans. Det har også blitt brukt i behandlingen av kviser.
Borsyre drysses i sokker for å forhindre føtters infeksjoner, for eksempel atletens fot. På samme måte brukes løsninger som inneholder borsyre i behandlingen av ytre otitis hos mennesker, så vel som hos dyr.
Borsyre tilsettes i flaskene som brukes til urininnsamling, som forhindrer bakteriell forurensning før de blir undersøkt i diagnostiske laboratorier.
Det kan tjene deg: Indolaldiksyre: Struktur, egenskaper, innhenting, brukInsektmiddel
Borsyre brukes til kontroll av insektspredning, for eksempel kakerlakker, termitter, maur, etc. Kakerlakkene dreper ikke øyeblikkelig, ettersom den først påvirker fordøyelses- og nervesystemene, i tillegg til å ødelegge eksoskjelettet.
Borsyre utøver sin handling sakte, slik at insekter som har inntatt den til å komme i kontakt med andre insekter, og dermed spre forgiftning.
Bevaring
Borsyre brukes til å forhindre treangrep av sopp og insekter, og bruker til dette formålet i forbindelse med etylenglykol. Denne behandlingen er også effektiv i kontroll av silt og alger.
PH støtdemper
Borsyre og dens konjugerte base danner et PKA -dempingssystem = 9.24, noe som indikerer at denne støtdemperen har sin største effektivitet til alkalisk pH, som ikke er vanlig i levende vesener. Borato støtdemper brukes imidlertid i pH -regulering i bassenger.
Atomreaktorer
Borsyre har evnen til å fange termiske nøytroner, noe som reduserer muligheten for ikke -kontrollert kjernefysisk fisjon som kan gi kjernefysiske ulykker.
Jordbruk
Boro er et essensielt element for plantevekst, noe som induserte bruken av borsyre for elementets bidrag. Imidlertid kan borsyre skade på planter, spesielt sitrusfrukter.
Kontraindikasjoner
Bruken av borsyre på den denudtede huden, sår- eller forbrenningsproduktet som tillater absorpsjon av det samme må unngås. Dette er en giftig forbindelse inne i kroppen, og i noen tilfeller kan den forårsake besvimelse, anfall, spasmer, ansikts tics og arteriell hypotensjon.
Legen skal konsulteres for bruk av borsyre -vaginalkapsler hos gravide, siden det har blitt påpekt at fosterdeformasjoner og en reduksjon i barnets kroppsvekt ved fødselen kan produsere ved fødselen.
Plassering av borsyre, brukt som et insektmiddel, på steder som er tilgjengelige for barn, siden barn har en større mottakelighet for den giftige virkningen av borsyre, og etablerer i dem den fatale dosen i 2.000 til 3.000 mg.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). BORSYRE. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). BORSYRE. PubChem -database. CID = 7628. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Redaktørene av Enyclopaedia Britannica. (28. mars 2019). BORSYRE. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Transportør vibrerer. (9. november 2018). De skjulte ussene av Buric Acid i ditt daglige liv. Gjenopprettet fra: CarrierVibrating.com
- Nasjonalt informasjonssenter for plantevernmidler. (s.F.). BORSYRE. Gjenopprettet fra: NPIC.Orst.Edu
- Tegning. (30. november 2017). Borsyre: egenskaper og bruk av denne kjemiske forbindelsen. Hentet fra: Syrer.Info
- Chlorurosodium. (2019). Borsyre. Gjenopprettet fra: Chlorurosodium.com
- Spanish Society of Hospital Pharmacy. (s.F.). Borsyre. [PDF]. Hentet fra: Grupper av arbeid.Sefh.er
- « Optisk komparator hva er bruken av og deler
- 11 fordeler med resirkulering i samfunnet (med eksempler) »

