Molekylstruktur cyanhydrikkyre, egenskaper, bruk

- 1091
- 268
- Jonathan Moe
Han hydrocyansyre o Hydrogencyanid er en organisk forbindelse hvis kjemiske formel er HCN. Det er også kjent som metanonitril.
Cyanhydronsyre er en fargeløs, ekstremt giftig gass, som oppnås når du behandler cyanider med syrer. Denne syren er plassert inne i det erte frø, også kjent mange steder som en fersken.
 Ferskenfrø, som inneholder hydrogencyanid eller hydrogencyanid, HCN. An.Ha [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikipedia Commons.
Ferskenfrø, som inneholder hydrogencyanid eller hydrogencyanid, HCN. An.Ha [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikipedia Commons. Ved omgivelsestemperatur er mindre enn 25 ºC en væske og over at temperaturen er en gass. I begge tilfeller er det ekstremt giftig for mennesket, dyr og til og med flertallet av mikroorganismer som ikke er akklimatisert til det. Det er et godt løsningsmiddel for ioner. Det er veldig ustabilt fordi det har en tendens til å enkelt polymerisere.
Det finnes i vegetabilsk rike innarbeidet i molekylene til noen glukosider, fordi når de er hydrolysert av enzymer i grønnsaken, oppnås HCN, glukose og benzaldehyd.
Disse glukosidene er inne i frøene til visse frukt som fersken, aprikos, kirsebær, plommer og i bitre mandler, så de skal aldri bli inntatt.
Det finnes også i planter som noen typer sorghum. I tillegg produserer noen bakterier det under stoffskiftet. Det brukes mest i polymerproduksjon og i noen metallurgiske prosesser.
HCN er en dødelig gift på grunn av innånding, inntak og kontakt. Det er til stede i røyk fra sigaretten og i røyk fra ilden av plast og materialer som inneholder karbon og nitrogen. Det anses som en luftforurensende å oppstå under forbrenningen av organisk materiale fra omfattende områder av planeten.
[TOC]
Molekylstruktur og elektronisk konfigurasjon
Hydrogensyanid eller cyanidsyre er en kovalent, molekylær forbindelse, med et hydrogenatom, et karbon og et nitrogen.
Karbon og nitrogenatom deler 3 par elektroner, så de danner en trippelkobling. Hydrogen er knyttet til karbon, som med denne foreningen presenterer sin Valencia de Cuatro og dets komplette elektronoktett.
Nitrogenet presenterer en fem Valencia på fem og for å fullføre oktetten har et par forsvinnede eller ensomme elektroner plassert lateralt.
HCN er derfor et helt lineært molekyl, med et par manglende elektroner lokalisert sideveis i nitrogen.
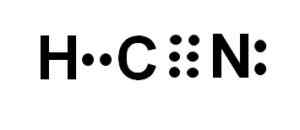 Lewis -representasjon av cyanhydronsyren, der elektronene delte i hver binding og paret med ensomme nitrogenelektroner blir observert. Forfatter: Marilú Stea.
Lewis -representasjon av cyanhydronsyren, der elektronene delte i hver binding og paret med ensomme nitrogenelektroner blir observert. Forfatter: Marilú Stea. 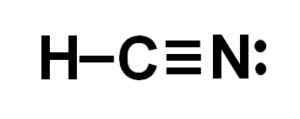 Hydrogencyanid eller hydrogencyanidstruktur der trippelbindingen mellom karbon og nitrogen observeres. Forfatter: Marilú Stea.
Hydrogencyanid eller hydrogencyanidstruktur der trippelbindingen mellom karbon og nitrogen observeres. Forfatter: Marilú Stea. Nomenklatur
- Hydrocyansyre
- Hydrogensyanid
- Metanonitril
- Formonitril
- Hydrocyansyre
Egenskaper
Fysisk tilstand
Under 25,6 ºC, hvis den er vannfri og stabilisert, er den en veldig ustabil og giftig blekblå væske eller blå. Hvis det er over at temperaturen er en ekstremt giftig fargeløs gass.
Molekylær vekt
27,03 g/mol
Smeltepunkt
-13,28 ºC
Kokepunkt
25,63 ºC (merk at den koker like over omgivelsestemperaturen).
Flashpoint
-18 ºC (lukket koppmetode)
Selvretningstemperatur
538 ºC
Kan tjene deg: gasskromatografiTetthet
0,6875 g/cm3 ved 20 ºC
Løselighet
Helt blandbar med vann, etylalkohol og etyleter.
Dissosiasjonskonstant
K = 2,1 x 10-9
Pktil = 9.2 (det er en veldig svak syre)
Noen kjemiske egenskaper
HCN har en veldig høy dielektrisk konstant (107 til 25 ° C). Dette er fordi molekylene deres er veldig polare og er assosiert av hydrogenbroer, som i tilfelle av vann h2ENTEN.
For å ha en så høy dielektrisk konstant, viser HCN seg å være et godt ioniserende løsningsmiddel.
Den flytende vannfrie HCN er veldig ustabil, den har en tendens til å polymerisere voldsomt. For å unngå dette blir stabilisatorer lagt til, som en liten prosentandel av H2SW4.
I vandig løsning og i nærvær av ammoniakk og adeninform, forbindelse som er en del av DNA og RNA, det vil si et biologisk viktig molekyl.
Det er en veldig svak syre, siden dens ioniseringskonstant er veldig liten, så det er bare delvis i vann som gir cyanidanionen CN-. Danner salter med basene, men ikke med karbonater.
Hans vandige oppløsninger som ikke er beskyttet mot lys, blir sakte dekomponert og genererer ammoniumformiatri hcoonh4.
I løsning presenterer det en svak lukt av mandler.
Korrosivitet
Fordi det er en svak syre, er den generelt ikke etsende.
Imidlertid angriper HCN vandige oppløsninger som inneholder svovelsyre som en stabilisator sterkt stål ved temperaturer større enn 40 ºC og rustfritt stål ved temperaturer større enn 80 ° C.
I tillegg kan HCN fortynne vandige oppløsninger forårsake karbonstål selv ved romtemperatur.
Du kan også angripe noen typer gummi, plast og belegg.
Plassering i naturen
Det er relativt rikelig i at plantekongeriket er en del av glukosider.
For eksempel genereres det fra mandelin C6H5-CH (-Cn) -O-glycose-glycose, sammensatt til stede i bitre mandler. Tonsilen er et cyanogent beta-glukosid, fordi når det hydrolysiserte det danner to glukosemolekyler, en av benzaldehyd og en av HCN. Enzymet som frigjør dem er beta-glukoksidase.
Tonsil kan finnes i frøene til fersken, aprikos, bitre mandler, kirsebær og plommer.
Noen typer sorghumplanter inneholder den cyanogene glucóside kalt Durrina (det vil si P-hydroksy- (S) -Mandelonitrilo-beta-d-glukosid). Denne forbindelsen kan nedbrytes ved to -trinns enzymatisk hydrolyse.
Først hydrinosa enzymet som er endogent i sorghumplanter hydrolys med glukose og p-hydroksy- (S) -Mandelonitrilo. Deretter blir sistnevnte raskt gratis HCN og p-hydroxibenzaldehyd.
 Sorghumanlegg med høyt Durrina -innhold. Ingen maskinlesbar forfatter gitt. Pethan antatt (basert på copyright -krav). [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikipedia Commons.
Sorghumanlegg med høyt Durrina -innhold. Ingen maskinlesbar forfatter gitt. Pethan antatt (basert på copyright -krav). [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikipedia Commons. HCN er ansvarlig for motstanden til sorghumplanter mot skadedyr og patogener.
Dette forklares med at Durrina og Durrinosa -enzymet har forskjellige steder i disse plantene, og kommer i kontakt bare når vevene er skadet eller ødelagt, slipper HCN og beskytter infeksjonsplanten som kan trenge gjennom den skadede parten.
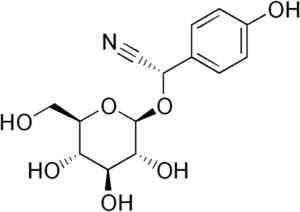 Durrina -molekyl der trippel CN -bindingen blir observert at ved enzymatisk hydrolyse produserer HCN. Edgar181 [offentlig domene]. Kilde: Wikipedia Commons.
Durrina -molekyl der trippel CN -bindingen blir observert at ved enzymatisk hydrolyse produserer HCN. Edgar181 [offentlig domene]. Kilde: Wikipedia Commons. I tillegg er noen patogene bakterier fra mennesket som som Pseudomonas aeruginosa og P. Gingivalis De produserer det under sin metabolske aktivitet.
applikasjoner
Ved fremstilling av andre kjemiske og polymerforbindelser
Bruken som involverer det meste av HCN produsert på industrielt nivå er utarbeidelsen av mellommenn for organisk syntese.
Kan tjene deg: jernoksid (ii): struktur, nomenklatur, egenskaper, brukDet brukes i adiponitrilsyntese NC- (CH2)4-CN, som brukes til å fremstille nylon eller nylon, et polyamid. Det tjener også til å forberede Acrilonitrilo eller Cianoethylene Cho2= CH-CN, brukt til å fremstille akryl- og plastfibre.
Dets derivat natriumcyanid brukes til utvinning av gull i gruvedrift av dette metallet.
En annen av dets derivater clcn cyanogenklorid tjener til plantevernmidler for plantevernmidler.
HCN brukes til fremstilling av chelateringsmidler som EDTA (Ethylen-Diamino-Tetra-Acetato).
Det tjener for fremstilling av ferrocyanider og noen farmasøytiske produkter.
Ulike bruksområder
HCN -gass har blitt brukt som et insektmiddel, soppmiddel og desinfeksjonsmiddel, for skip og bygninger Fumigation. Også for å fumre møbler for å gjenopprette dem.
HCN har blitt brukt i metallpolish.
For hans veldig høye toksisitet ble han utnevnt til et kjemisk krigsmiddel.
I landbruket
Det har blitt brukt som ugressmiddel og plantevernmiddel i frukthager. Han hadde brukt til å kontrollere skalaer og andre patogener av sitrustrær, men noen av disse skadedyrene har blitt resistente mot HCN.
Det har også blitt brukt til å fumre kornsiloer. Den gassformige HCN tilberedt på stedet har blitt brukt i fumigering av hvetekorn for å bevare dem fra skadedyr som insekter, sopp og gnagere. For denne bruken er det viktig at frø blir fumigert til plantevernmiddeltagen.
Tester som fumigerer hvetefrø er gjort med HCN, og det har blitt funnet at spiringspotensialet til disse ikke påvirker, snarere ser det ut til å favorisere det.
Imidlertid kan høye doser av HCN redusere lengden på små blader som spirer fra frøet betydelig.
På den annen side, på grunn av det faktum at det er et kraftig nematikid og at noen sorghumplanter besitter det i vevet, blir potensialet til sorghumplanter undersøkt for å brukes som biocidgrønn gjødsel.
Bruken vil tjene til å forbedre jordsmonn, undertrykke ugress og kontrollsykdommer og skade forårsaket av fytoparasittiske nematoder.
Risiko
For mennesket er HCN en dødelig gift på alle ruter: innånding, inntak og kontakt.
 Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay.
Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay. Inhalert kan være dødelig. Det anslås at omtrent 60-70% av befolkningen kan oppdage lukten av bitre HCN-mandler når den er i luft i en konsentrasjon på 1-5 ppm.
Men det er 20% av befolkningen som fremdeles ikke kan oppdage det ved dødelige konsentrasjoner for å være genetisk ute av stand til å gjøre det.
Inntatt er en akutt og øyeblikkelig action gift.
Hvis løsningene dine kommer i kontakt med huden, kan tilknyttet cyanid være dødelig.
HCN er til stede i sigarettrøyken og den som genereres når plast som inneholder nitrogen blir brent.
Dødelig handlingsmekanisme innen organismen
Det er et kjemikalie og er raskt giftig, og fører ofte til døden. Når du kommer inn i organismen, blir den sammen med metalloenzymene (enzymer som inneholder et metallion) som inaktiverer dem. Det er et giftig middel for flere organer i menneskekroppen
Den viktigste toksiske effekten består i hemming av cellulær respirasjon, siden det deaktiverer et enzym som påvirker fosforylering i mitokondrier, som er organeller som blant annet griper inn.
Kan tjene deg: kalium permanganat (kmno4)Sigarettrøykrisiko
HCN er til stede i sigarettrøyk.
Selv om mange vet effekten av å forgifte HCN, er det få som er klar over at de blir utsatt for deres skadelige effekt gjennom sigarettrøyk.
HCN er en av årsakene til hemming av flere luftveis enzymer. Mengden HCN som er til stede i sigarettrøyk har en skadelig effekt på nervesystemet.
HCN -nivåer er rapportert i sigarettrøyk mellom 10 og 400 μg per sigarett for røyken direkte og 0,006 til 0,27 μg/sigarett for sekundær innånding (passiv røyker). HCN gir giftige effekter fra 40 μm og utover.
 Forfatter: Alexas Bilder. Kilde: Pixabay.
Forfatter: Alexas Bilder. Kilde: Pixabay. Å bli inhalert kommer raskt inn i blodomløpet, hvor han frigjøres i plasmaet eller binder seg til hemoglobin. En liten del konverterer til Tiocianato og skilles ut av urin.
HCN oppvarmingsrisiko
Langvarig eksponering for varmen fra den flytende HCN i lukkede beholdere kan forårsake voldelig og uventet brudd på disse. Det kan eksplosivt polymerisere 50-60 ºC i nærvær av alkaliske spor og i fravær av hemmere.
Tilstedeværelse av HCN i brannrøyk
HCN frigjøres under forbrenningen av polymerer som inneholder nitrogen, for eksempel ull, silke, polyakrylonitrilos og nylon, blant andre. Disse materialene er til stede i våre hjem og på de fleste steder med menneskelig aktivitet.
Av denne grunn under brannene kan HCN potensielt være dødsårsaken ved innånding.
Atmosfæreforurensende
HCN er en forurensning av troposfæren. Det er motstandsdyktig mot Photólysis og under miljøforholdene i atmosfæren lider ikke hydrolyse.
OH -hydroksylradikaler • Produsert fotokjemisk kan reagere med HCN, men reaksjonen er veldig treg, så halvlivet til HCN i atmosfæren er 2 år.
Når biomasse brenner, spesielt MOB, slippes HCN til atmosfæren, og også under industrielle aktiviteter. Imidlertid er torvforbrenning 5 til 10 ganger mer forurensende enn å brenne annen type biomasse.
Noen forskere har funnet at høye temperaturer og tørke forårsaket av El Niño -fenomenet i visse områder av planeten forverrer.
 Forfatter: Steve Buissinne. Kilde: Pixabay.
Forfatter: Steve Buissinne. Kilde: Pixabay. Dette fører til en intens forbrenning av biomasse i tørre stasjoner.
Disse hendelsene er kilden til høye konsentrasjoner av HCN i troposfæren, som til slutt blir transportert til den lave stratosfæren, og gjenstår i veldig lang tid.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- ELLER.S. National Library of Medicine. (2019). Hydrogensyanid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Gidlow, d. (2017). Hydrogen cyanid-en oppdatering. Yrkesmedisin 2017; 67: 662-663. NCBI kom seg.NLM.NIH.Gov.
- Van Nostrands vitenskapelige leksikon. (2005). Hydrogensyanid. 9th Hentet fra online bibliotek.Wiley.com.
- Ren, og.-L. et al. (nitten nittiseks). Effekt av hydrogencyanid og karbonylsulfid på spiring og plumulehastighet av hvete. Pestic. Sci. 1996, 47, 1-5. Hentet fra online bibliotek.Wiley.com.
- Fra Nicola, g.R. et al. (2011). Til enkel analytisk metode for evaluering av dhurrininnhold i cyanogene planter for deres bruk i fôr og biofumigering. J. Agric. Food Chem. 2011, 59, 8065-8069. Gjenopprettet fra puber.ACS.org.
- Sheese, s.OG. et al. (2017). En global forbedring av hydrogensyanid i nedre stratosfære gjennom 2016. Geophys. Storfekjøtt. Lett., 44, 5791-5797. Gjenopprettet fra Agupubs.Online bibliotek.Wiley.com.
- Surleva, a.R. og drochioiu, g. (2013). Visualisering Røykefare: Enkel spektrofotometrisk bestemmelse av hydrogencyanid i sigarettrøyk og filtre. J. Chem. Utdanning. 2013, 90, 1654-1657. Gjenopprettet fra puber.ACS.org.
- Alarie, og. et al. (1990). Rollen som hydrogensyanid i menneskelige dødsfall i ild. I brann og polymerer. kapittel 3. ACS Symposium Series. Gjenopprettet fra puber.ACS.org.
- « Krominsyrestruktur, egenskaper, innhenting, bruker
- 8 eksperimenter med veldig kontroversielle mennesker »

