Krominsyrestruktur, egenskaper, innhenting, bruker

- 2581
- 204
- Markus Fredriksen
Han kromsyre eller h2Cro4 Syren assosiert med kromoksyd (VI) eller Cro Cromic Oxide er teoretisk3. Dette kirkesamfunnet skyldes at i de sure vandige oppløsningene av det kromoksydet hartene H2Cro4 Det er til stede med andre kromarter (VI).
Cromic oksid3 Det kalles også vannfri kromsyre. CRO3 Det er et rødlig eller lilla brunt fast stoff som oppnås når du behandler kaliumdikromatløsninger k2Cr2ENTEN7 Med svovelsyre H2SW4.
 Cromic oksid knuses3 I en smeltedigel. Rando Tuikene [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikipedia Commons.
Cromic oksid knuses3 I en smeltedigel. Rando Tuikene [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikipedia Commons. Vandige kromoksydløsninger opplever en balanse av visse kjemiske arter hvis konsentrasjon avhenger av pH i løsningen. Grunnleggende pH dominerer cromate -ioner CRO42-, Mens hcro acidioner dominerer4- og Cr Dicromato2ENTEN72-. Det anslås at sure syre også er til stede kromsyre h2Cro4.
På grunn av sin store oksidasjonskraft brukes kromsyreoppløsninger i organisk kjemi for å utføre oksidasjonsreaksjoner. De brukes også i elektrokjemiske prosesser for å behandle metaller slik at de får motstand mot korrosjon og slitasje.
Visse polymermaterialer blir også behandlet med kromsyre for å forbedre vedheftet til metaller, malerier og andre stoffer.
Kromsyreoppløsninger er svært farlige for både mennesker og de fleste dyr og miljøet. Av denne grunn blir væske- eller faste prosesser avfall der kromsyre brukes behandlet for å eliminere krom (VI), for å gjenvinne alle nåværende krom og regenerere kromsyre for å gjenbruke den.
[TOC]
Struktur
Kromsyremolekylet H2Cro4 Det dannes av en cromato cro ion42- og to hydrogenioner h+ Forent til dette. I kromatet er kromelementet i en +6 oksidasjonstilstand.
Den romlige strukturen til kromationet er tetrahedral, der krom er i sentrum og oksygen okkuperer de fire hjørnene i tetrahedronen.
I kromsyre er hydrogenatomer hver ved siden av et oksygen. Av de fire krombindingene med oksygenatomene er to doble og to er enkle, ettersom de har hydrogenene forenet for dem.
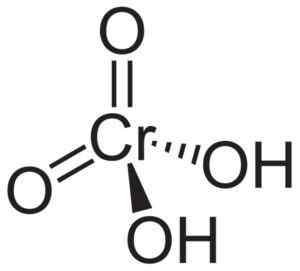 Kromsyrestruktur h2Cro4 Hvor den tetraedriske formen for krom og dobbeltbindinger blir observert. Neuroteker [Public Domain]. Kilde: Wikipedia Commons.
Kromsyrestruktur h2Cro4 Hvor den tetraedriske formen for krom og dobbeltbindinger blir observert. Neuroteker [Public Domain]. Kilde: Wikipedia Commons. På den annen side, Cro -Croomic Oxide3 Det har et oksidasjonskromatom +6 omgitt av bare tre oksygenatomer.
Nomenklatur
- Cromic Acid H2Cro4
- Tetraoksokromsyre H2Cro4
- Cromic Oxide (vannfri kromsyre) CRO3
- Kromtrioksid (vannfri kromsyre) CRO3
Egenskaper
Fysisk tilstand
Anhydro eller kromoksydkromsyre er et krystallinsk fast stoff av lilla til rød
Molekylær vekt
Cro3: 118,01 g/mol
Smeltepunkt
Cro3: 196 ºC
Over smeltepunktet er termisk ustabilt, mister det oksygen (det reduseres) for å gi kromoksid (III) CR2ENTEN3. Den dekomponerer med omtrent 250 ºC.
Tetthet
Cro3: 1,67-2,82 g/cm3
Løselighet
CRO3 Det er veldig løselig i vann: 169 g/100 g vann ved 25 ºC.
Det er løselig i mineralsyrer som svovel og nitrogen. Alkoholoppløselig.
Andre egenskaper
CRO3 Det er veldig hygroskopisk, krystallene er deilige.
Når CRO3 Det oppløses i vannformer sterkt sure løsninger.
Kan tjene deg: titan: historie, struktur, egenskaper, reaksjoner, brukDet er en veldig kraftig oksidant. Oksy kraftig organisk materiale i nesten alle former. Angriper stoffet, lær og litt plast. De fleste metaller angriper også.
Det er sterkt giftig og veldig irriterende på grunn av dets høye oksidasjonspotensial.
Kjemi av vandige oppløsninger der kromsyre er til stede
Cromic oksid3 Det oppløses raskt i vann. I vandig løsning kan krom (VI) eksistere i forskjellige ioniske former.
En pH> 6,5 eller i alkalisk løsning Krom (VI) skaffer seg cromato -ionformen42- gul.
Hvis pH er redusert (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , som kan dimerisere til ion dicromato cr2ENTEN72-, Og løsningen blir oransje. Ved pH mellom 2,5 og 5,5 er den dominerende arten HCRO4- og Cr2ENTEN72-.
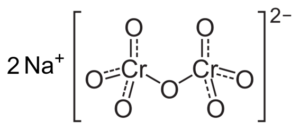 Cr Dicromate Ion Structure2ENTEN72- som ligger ved siden av to natriumnaioner+. Capacio [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikipedia Commons.
Cr Dicromate Ion Structure2ENTEN72- som ligger ved siden av to natriumnaioner+. Capacio [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikipedia Commons. Balansen som oppstår i disse løsningene når pH går ned er følgende:
Cro42- (kromat ion) + h+ ⇔ Hcro4-
Hcro4- + H+ ⇔ H2Cro4 (kromsyre)
2HCRO4- ⇔ Cr2ENTEN72- (Dikromation) + H2ENTEN
Disse balansene oppstår bare hvis syren som tilsettes for å senke pH er3 eller hclo4, fordi med andre syrer dannes forskjellige forbindelser.
De sure løsningene av dikromat er veldig energiske oksidasjonsmidler. Men i alkaliske løsninger er kromationet mye mindre oksidant.
Å skaffe
I følge kildene som ble konsultert, er en av måtene å skaffe Cro Cromic Oxide3, Dette består av tilsetning av svovelsyre til en vandig løsning av natrium eller kaliumdikromat, og danner et rødt oransje bunnfall.
 Cromic oksid hydrert eller kromsyre. Himstakan [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikipedia Commons.
Cromic oksid hydrert eller kromsyre. Himstakan [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikipedia Commons. Cromic Acid H2Cro4 Det finnes i vandige kromoksydløsninger i surt medium.
Kromsyre bruker
I oksidasjon av kjemiske forbindelser
På grunn av dens sterkt oksidasjonskapasitet, har kromsyre blitt brukt i lang tid og vellykket for å oksidere organiske og uorganiske forbindelser.
Blant utallige eksempler er følgende: det tillater oksiderende primære alkoholer til aldehydos og disse til karboksylsyrer, alkoholer sekundært til ketoner, toluen til benzosyre, etylbenzen til acetofenon, trifenylmetano til trifenylcarbinol, formic acida co -co -co2, oksalsyre til CO2, melkesyre til acetaldehyd og co2, Jernholdig tro2+ En jern tro tro3+, ionjodid til jod, etc.
Tillater konvertering av lystgass-komprimerende til nitro-komponenter, sulfider til sulfoner. Det griper inn i syntesen av ketoner basert på alkener, som oksiderte de hydroborerte alkenene til ketoner.
Forbindelser veldig motstandsdyktige mot vanlige oksidanter, for eksempel oksygen eller2 eller hydrogenperoksyd H2ENTEN2, De oksideres av kromsyre. Dette er tilfelle av visse heterocykliske bastesses.
I metallanodiseringsprosesser
Kromsyreanodisering er en elektrokjemisk behandling som gjelder aluminium for å beskytte den i mange år mot oksidasjon, korrosjon og slitasje.
Anodiseringsprosessen involverer den elektrokjemiske dannelsen av et lag med aluminiumoksid eller aluminiumoksyd på metall. Dette laget blir deretter forseglet i varmt vann, som oppnås ved konvertering til trihydrert aluminiumoksyd.
Det forseglede oksydlaget er tykt, men det er strukturelt svakt og ikke veldig tilfredsstillende for påfølgende limforeninger. Imidlertid, ved å tilsette en liten mengde kromsyre til tetningsvann, utvikles en overflate som kan danne gode bindinger.
Kan tjene deg: lov om bevaring av materieKromsyre i tetningsvann løser opp en del av den tykke cellestrukturen og etterlater en tynn, sterk, godt festet til aluminiumoksyd, som limene stikker og danner sterke og varige ledd.
Anodisering med kromsyre gjelder også titan og legeringer.
I kjemiske konverteringsbehandlinger
Kromsyre brukes i metallbeleggingsprosesser ved kjemisk konvertering.
Under denne prosessen er metaller nedsenket i kromsyreoppløsninger. Dette reagerer og løses delvis overflaten avsetning samtidig som et tynt lag med komplekse kromforbindelser som samhandler med basismetallet.
Denne prosessen kalles kromatkonverteringsbelegg eller konvertering krom.
Metallene som generelt blir utsatt for konverteringskrom er forskjellige ståltyper, for eksempel karbonstål, rustfritt stål og sinkbelagt stål, og flere ikke -gerrous metaller, for eksempel magnesiumlegeringer, tinnlegeringer, aluminiumslegeringer, kobber, kadmium, mangan og sølv.
Denne behandlingen gir korrosjon og lysstyrke mot metall. En høyere pH i prosessen større motstand mot korrosjon. Temperaturen akselererer syrereaksjonen.
Belegg av forskjellige farger kan påføres, for eksempel blå, svart, gull, gult og gjennomsiktig. Det gir også bedre tilslutning av metalloverflaten mot malerier og lim.
I erodert eller hakket overflate
Kromsyreoppløsninger brukes til fremstilling av overflaten av termoplastisk materiale, termosystible polymerer og elastomerer for senere belegg med malerier eller lim.
H2Cro4 oppnår en effekt på overflatekjemi og dens struktur, fordi det hjelper til med å øke dens ruhet. Kombinasjonen av bitt og oksidasjon øker penetrasjonen av lim og kan til og med forårsake endringer i polymeregenskapene.
Det har blitt brukt til å erodere forgrenet polyetylen av lav tetthet, høy tetthet og polypropylen lineær polyetylen.
Det brukes mye i elektro-motvirkningen eller galvanoplastikkindustrien for å lette metallpolymeradhesjon.
I flere bruksområder
Kromsyre brukes som konserveringsmiddel for tre, også i magnetiske materialer og for kjemiske reaksjoner katalyse.
Cromic Acid Recovery
Det er mange prosesser som bruker kromsyre og genererer strømmer eller rester som inneholder krom (III) som ikke kan kastes fordi de har kromioner (VI) som er veldig giftige eller gjenbruk fordi konsentrasjonen av kromationer er veldig lav.
Disposisjonen krever kjemisk reduksjon av kromater til krom (III), etterfulgt av hydroksyd og filtreringsutfelling, noe som genererer ekstra kostnader.
Av denne grunn har forskjellige metoder blitt studert for å fjerne og gjenopprette kromater. Her er noen av disse.
Gjennom harpiks bruk
I mange år har ionebytterharpikser for kromatforurenset vannbehandling blitt brukt. Dette er en av behandlingene som er godkjent av det amerikanske miljøvernbyrået, eller EPA (forkortelse for engelsk Miljøvernbyrå).
Denne metoden tillater utvinning av konsentrert kromsyre siden den blir regenerert igjen fra harpiksen.
Harpikser kan være sterk eller svak base. I sterkt grunnleggende harpikser kan kromatet fjernes som HCRO -ioner4- og Cr2ENTEN72- De byttes ut med OH -ioner- og cl-. I svakt grunnleggende harpikser, for eksempel sulfat, byttes ioner med SOS42-.
Kan tjene deg: nepelometriNår det gjelder sterkt grunnleggende harpikser R- (OH), er globale reaksjoner som følger:
2ROH + HCRO4- + H+ ⇔ r2Cro4 + 2H2ENTEN
R2Cro4 + 2HCRO4- ⇔ 2rhcro4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2ENTEN7 + H2ENTEN
For hver mol av r2Cro4 Å konvertere en mol av Cr (VI) av løsningen fjernes, noe som gjør denne metoden veldig attraktiv.
Etter fjerning av kromatene behandles harpiksen med en sterkt alkalisk løsning for å regenerere dem på et trygt sted. Deretter omdannes kromatene til konsentrert kromsyre som skal brukes på nytt.
Gjennom elektrokjemisk regenerering
En annen metode er den elektrokjemiske regenerasjonen av kromsyre, som også er et veldig praktisk alternativ. Gjennom denne prosedyren oksideres Chrome (III) til Chrome (VI). Anodematerialet i disse tilfellene er fortrinnsvis blydioksid.
Bruk av mikroorganismer for å rydde opp avløpsvann med kromsyre gjenstår
En metode som er undersøkt og fortsatt er under studie er bruken av mikroorganismer som er til stede naturlig i visse avløp.
 Skadelige avløpsvann for miljøet. Forfatter: OpenClipart-vektorer. Kilde: Pixabay.
Skadelige avløpsvann for miljøet. Forfatter: OpenClipart-vektorer. Kilde: Pixabay. Slik er tilfellet med visse bakterier som er til stede i solvannsvannets farvann. Disse mikrober er blitt studert og bestemt at de er resistente mot kromater og er også i stand til å redusere krom (VI) til krom (iii), noe som er mye mindre skadelig for miljøet og levende vesener.
Av denne grunn anslås det at de kan brukes som en miljøvennlig metode for sanering og avgiftning av avløpsvann som er forurenset med kromsyre, gjenstår.
Kromsyrerisiko og kromoksid
CRO3 Det er ikke drivstoff, men kan intensivere forbrenningen av andre stoffer. Mange av reaksjonene dine kan forårsake brann eller eksplosjon.
CRO3 Og kromsyreoppløsninger er kraftig irriterende hud (de kan forårsake dermatitt), øyne (kan brenne dem) og slimhinner (kan forårsake bronkasma) og kan forårsake de såkalte "kromhulene" i luftveissystemet.
Kromforbindelser (VI) som kromsyre og kromoksyd er sterkt giftige, mutagene og kreftfremkallende.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- ELLER.S. National Library of Medicine. (2019). Kromsyre. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wegman, r.F. og Van Twisk, J. (2013). Aluminium og aluminiumslegeringer. 2.5. Kromsyre anodisere prosessen. I overflateforberedelsesteknikker for limbinding (andre utgave). Gjenopprettet fra Scientedirect.com.
- Wegman, r.F. og Van Twisk, J. (2013). Magnesium. 6.4. Forberedelse av magnesium- og magnesiumlegeringer av kromsyrebehandlingsprosessene. I overflateforberedelsesteknikker for limbinding (andre utgave). Gjenopprettet fra Scientedirect.com.
- Grot, w. (2011). applikasjoner. 5.1.8. Kromsyre regenerering. I fluorerte Ionomers (andre utgave). Gjenopprettet fra Scientedirect.com.
- Swift, k.G. og Booker, J.D. (2013). Overflateteknisk prosess. 9.7. Kromating. I håndbok for produksjonsprosessutvalg. Gjenopprettet fra Scientedirect.com.
- Poulson, a.H.C. et al. (2019). Overflatemodifiseringsteknikker for PIEK, inkludert plasmaoverflatebehandling. elleve.3.2.1. Overflateetsing. I Peek Biomaterials Handbook (Second Edition). Gjenopprettet fra Scientedirect.com.
- Westheimer, f.H. (1949). Mekanismene for kromsyreoksidasjoner. Kjemiske anmeldelser 1949, 45, 3, 419-451. Gjenopprettet fra puber.ACS.org.
- Tan, h.K.S. (1999). Kromsyreopphold ved anionutveksling. The Canadian Journal of Chemical Engineering, bind 77, februar 1999. Hentet fra online bibliotek.Wiley.com.
- Kabir, m.M. et al. (2018). Isolasjon og karakterisjon av krom (VI) -reduserende bakterier fra garveriutløp og fast avfall. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI kom seg.NLM.NIH.Gov.
- « Industrielle landskapskarakteristikker, elementer og eksempler
- Molekylstruktur cyanhydrikkyre, egenskaper, bruk »

