Hva er disulfuric hva er, struktur, egenskaper, bruker
- 1044
- 130
- Prof. Theodor Gran
Hva er disulfurinsyre?
Han disulfurinsyre Det er en av de mange svoveloksoacidene, hvis kjemiske formel er h2S2ENTEN7. Formelen indikerer eksplisitt at det er to svovelatomer, og som navnet også påpeker, må det være to H -molekyler2SW4 bare en; Imidlertid er det syv oksygen i stedet for åtte, så en svovel må ha tre.
Denne syren er som en av hovedkomponentene i oljen (eller røyk svovelsyre), som blir en "tett" form av svovelsyre. Slik er deres overvekt, som noen anser olje som et synonym for disulfurinsyre; som også er kjent med det tradisjonelle navnet på pyrosulfurinsyre.
I bildet vises en mottaker med olje, med en konsentrasjon av svoveltrioksid, så3, 20 %. Dette stoffet er preget av å være fet og fargeløst; Selv om gulaktig eller brun kan bli gul avhengig av konsentrasjonen av SO3 og av tilstedeværelsen av noen urenheter.
Ovennevnte forteller om deltakelsen av SO3 i h2S2ENTEN7; det vil si et H -molekyl2SW4 Reagere med en av det3 Å danne disulfurinsyre. Å være da, h2S2ENTEN7 Det kan også skrives som h2SW4· SW3.
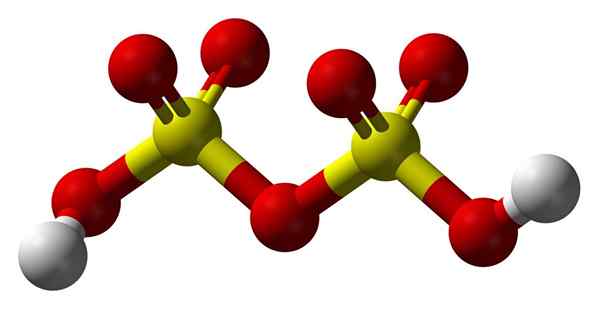
Disulfurinsyrestruktur
 Disulfurinsyrestruktur
Disulfurinsyrestruktur Opp2S2ENTEN7 I en sfærer- og barmodell. Legg merke til symmetrien til molekylet: venstre side av oksygenbroen er identisk med høyre. Fra det perspektivet kan strukturen beskrives med HO -formelen3Kjedelig3H.
I begge ender er hver hydroksylgruppe, hvis hydrogen, ved induktiv effekt av alle disse oksygenatomer, øker dens positive delvise belastning; Og følgelig har disulfurinsyre enda sterkere surhet enn svovelsyre.
Kan tjene deg: kaliumhydroksyd: struktur, egenskaper, brukMolekylet kan skrives som h2SW4· SW3. Dette refererer imidlertid mer til en sammensetning av oleum enn til strukturen til et molekyl.
Imidlertid, hvis et vannmolekyl tilsettes H2S2ENTEN7, To H -molekyler vil bli utgitt2SW4:
H2S2ENTEN7 + H2Eller 2H2SW4
Balansen kan bevege seg til venstre: til dannelse av h2S2ENTEN7 Fra h2SW4 Hvis det leveres varme. Det er av denne grunn til H2S2ENTEN7 Det er også kjent som pyrosulfurinsyre; Siden det kan genereres etter oppvarming av svovelsyre.
Også som nevnt i begynnelsen, h2S2ENTEN7 Det dannes av den direkte kombinasjonen av h2SW4 Og så3:
SW3 + H2SW4 H2S2ENTEN7
Egenskaper
 Oleum. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)], via Wikimedia Commons
Oleum. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)], via Wikimedia Commons Egenskapene til disulfurinsyre er ikke veldig godt definert, fordi det er ekstremt vanskelig å isoleres rent fra oljen.
Det må huskes at det kan være andre forbindelser i oljen, med h h2SW4· XSO3, hvor avhengig av verdien av x til og med kan ha polymerstrukturer.
En måte å visualisere det på er å forestille seg at den øvre strukturen til H2S2ENTEN7 blir mer langstrakt av flere enheter av SO3 og oksygenbroer.
I en nesten ren tilstand består den av et ustabilt krystallinsk fast stoff (røyking) som smelter ved 36 ºC. Imidlertid kan dette smeltepunktet variere avhengig av den sanne sammensetningen.
Disulfurinsyre kan danne det som kalles disulfater (eller pyrosulfat) salter. For eksempel, hvis du reagerer med kaliumhydroksyd, danner du kaliumpyrosulfat, k2S2ENTEN7.
I tillegg kan det kommenteres at den har en molekylvekt på 178 g/mol, og to syreekvivalenter (2 timer+ som kan nøytraliseres med en sterk base).
Kan tjene deg: flyktiggjøringSukkerdehydreringsreaksjon
Med denne oljeformet forbindelse kan en nysgjerrig reaksjon gjennomføres: transformasjonen av karbonblokkklumper.
H2S2ENTEN7 Den reagerer med sukker som eliminerer alle OH -grupper i form av vann, som favoriserer nye fagforeninger blant karbonatomer; Fagforeninger som ender opp med å forårsake svart kull.
Nomenklatur
Disulfurinsyre anses som anhydrid av svovelsyre; Det vil si at det mister et vannmolekylprodukt av kondens mellom to syremolekyler. Før så mange mulige navn for denne forbindelsen, anbefaler IUPAC -nomenklaturen ganske enkelt at disulfurinsyre.
Begrepet 'piro' henviser utelukkende til det som ble dannet som et produkt av varmeapplikasjon. IUPAC anbefaler ikke dette navnet for H2S2ENTEN7; Men det brukes fortsatt for øyeblikket av mange kjemikere.
Avslutningen -ICO forblir ufravikelig siden svovelatomet fortsetter å opprettholde en valens på +6. For eksempel kan det beregnes ved følgende aritmetiske operasjoner:
2H + 2S + 7O = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
applikasjoner
Lagrer svovelsyre
Disulfurinsyre, gitt sin eiendom til å stivne som olje, er i stand til å løse opp og lagre tryggere svovelsyre. Dette er fordi SO3 slipper unna å skape en uansvarlig "tåke", som er mye mer løselig i H2SW4 enn i vann. For å få h2SW4, Det ville være nok å legge til vannoljen:
H2S2ENTEN7 + H2Eller 2H2SW4
100% svovelsyresyntese
Fra forrige ligning, h2SW4 Det blir fortynnet i det tilsatte vannet. For eksempel, hvis du har en vandig løsning av H2SW4, Hvor så3 Det har en tendens til å unnslippe og representerer en risiko for arbeidere, og tilfører olje til løsning dette reagerer med vann som danner mer svovelsyre; det vil si å øke konsentrasjonen.
Det kan tjene deg: kjemisk ugjennomtrengeligHvis det er noe vann igjen, blir mer lagt til3, som reagerer med h2SW4 For å produsere mer disulfurinsyre eller olje, og deretter hydrerer det igjen "Tørking" H2SW4. Prosessen gjentar noen ganger nok til å oppnå svovelsyre ved en 100% konsentrasjon.
En lignende prosess brukes til å oppnå 100% salpetersyre. På samme måte har den blitt brukt til å dehydrere andre kjemiske stoffer, brukt til eksplosiv utdyping.
Sulfonering
Strukturer, for eksempel fargestoffer; det vil si legg til grupper -så3H, som mister syren protonet kan bli forankret til tekstilfiberpolymeren.
På den annen side brukes surheten i oleum for å oppnå den andre nitrasjonen (legg til grupper -ingen2) til de aromatiske ringene.
Referanser
- Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Pyrosulfurinsyre. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- « 20 oppfinnelser av renessansen som forandret verden
- Bakteriell utstryk hva er, egenskaper og forberedelser »

