Maursyre (HCOOH)
- 3686
- 359
- Mathias Aas
Vi forklarer hva som er maursyre, dens egenskaper, struktur og applikasjoner
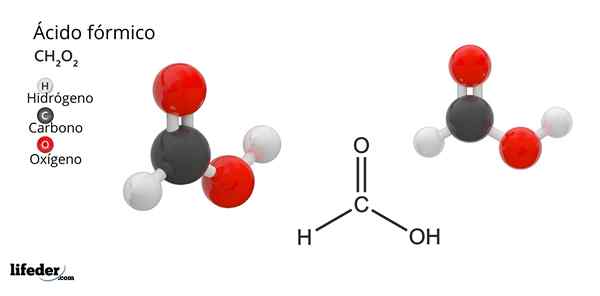
 Formel og struktur av maursyre
Formel og struktur av maursyre Hva er maursyre?
Han maursyre eller metansyreDet er den enkleste og små forbindelsen av alle organiske syrer. Det er også kjent som metansyre og dens molekylære formel er HCOOH, med bare et hydrogenatom knyttet til karbonatomet. Hans navn stammer fra ordet Formica, som på latin betyr maur.
Naturalistene i det femtende århundre fant at visse typer insekter (formícidos), som maur, termitter, bier og biller, skiller ut denne forbindelsen som er ansvarlig for deres smertefulle hakket. Disse insektene bruker også maursyre som en mekanisme for angrep, forsvar og kjemisk skilting.
De har giftige kjertler som skiller ut denne og andre syrer (for eksempel eddiksyre) som en dugg utenfor. Maursyre er sterkere enn eddiksyre (CH3Cooh); Derfor, oppløst i like store mengder i vann, produserer maursyre løsninger med lavere pH -verdier.
Den engelske naturforskeren John Ray oppnådde isolasjonen av maursyren i 1671, og destilerte den fra store mengder maur.
På den annen side ble den første vellykkede syntesen av denne forbindelsen utført av den franske kjemikeren og fysikeren Joseph Gay-Lussac, ved bruk av Night Acid (HCN) som reagens.
Hvor er maursyre?
 Maur utskiller maursyre
Maur utskiller maursyre Maursyre kan være til stede på terrestriske nivåer, som en komponent av biomasse eller i atmosfæren, involvert i et bredt spekter av kjemiske reaksjoner; Det kan til og med finnes under jordsmonnene, inne i olje eller i en gassfase på overflaten.
Når det gjelder biomasse, er insekter og planter de viktigste generatorene for denne syren. Når fossilt brensel blir brent, produserer gassformsyre; Følgelig frigjør kjøretøymotorer maursyre til atmosfæren.
Jorden er imidlertid vertskap. Også skogbranner representerer gassformige kilder til maursyre.
Det kan tjene deg: litium: historie, struktur, egenskaper, risikoer og bruksområderOver, i den komplekse atmosfæriske matrisen, oppstår fotokjemiske prosesser som syntetiserer maursyre.
På dette tidspunktet blir mange flyktige organiske forbindelser (VOC) degradert under effekten av ultrafiolett stråling, eller oksideres av frie radikale mekanismer OH. Den rike og komplekse atmosfæriske kjemien er langt den dominerende kilden til formell maursyre.
Maursyrestruktur
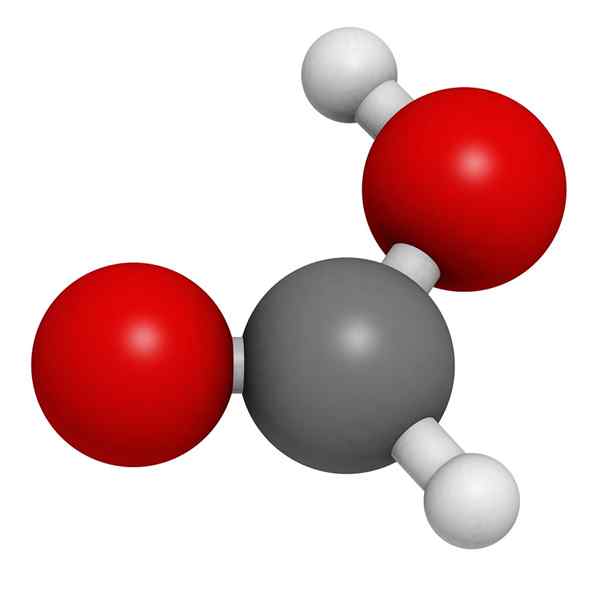 Molekylær modell av maursyre
Molekylær modell av maursyre I det overordnede bildet illustreres strukturen i en gassfase av maursyre. Hvite kuler tilsvarer hydrogenatomer, røde oksygen og svarte atomer til karbonatomer.
I disse molekylene kan to grupper verdsettes: hydroksyl (-OH) og formil (-Ch = O), begge i stand til å danne hydrogenbroer.
Disse interaksjonene er av O-H-O-typen, og er hydroksilgruppene giverne av H og gruppene formiler giverne av OR eller.
Imidlertid mangler H knyttet til karbonatomet denne kapasiteten. Disse interaksjonene er veldig sterke, og på grunn av atomet til H -dårlig i elektroner, er hydrogenet til OH -gruppen surere; Derfor stabiliserer dette hydrogenet broer ytterligere.
Som et resultat av det foregående, eksisterer maursyre i en boltform og ikke som et individuelt molekyl.
Krystallinsk struktur
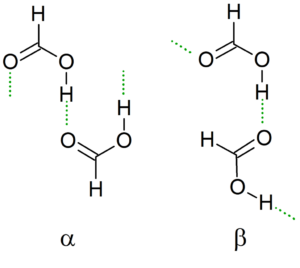
Når temperaturen går ned, guider dimeren hydrogenbroene for å generere den mest stabile mulige strukturen sammen med de andre dimerer, og skaper dermed uendelige kjeder α og β av maursyre.
En annen nomenklatur er "cis" og "trans" -konformere. I dette tilfellet brukes "cis" til å utpeke grupper som er orientert i samme retning, og "trans" for disse gruppene i motsatte adresser.
Kan tjene deg: Tanteo Balanse: Trinn, eksempler og øvelserFor eksempel, i α -kjeden "peker" peker "til samme side (venstre), i motsetning til ß -kjeden, der disse formylgruppene peker på motsatte sider (overlegen bilde).
Denne krystallinske strukturen avhenger av de fysiske variablene som virker på den, for eksempel trykk og temperatur. Dermed er kjeder konvertible; Det vil si under forskjellige forhold kan en "cis" -kjede omdannes til en "trans" -kjede, og omvendt.
Hvis trykk øker til drastiske nivåer, komprimeres kjeder nok til å bli betraktet som en krystallinsk polymer av maursyre.
Maursyreegenskaper
De fysiske og kjemiske egenskapene til maursyre er nevnt nedenfor:
- Maursyre er en væske ved romtemperatur, fargeløs og med en sterk og gjennomtrengende lukt. Den har en molekylvekt på 46 g/mol, den smelter til 8,4 ° C og har et kokepunkt på 100,8 ºC, større enn vann.
- Det er blandbar i vann og polare organiske løsningsmidler, som eter, aceton, metanol og etanol.
- På den annen side, i aromatiske løsningsmidler (som benzen og toluen), er det litt løselig, fordi maursyren knapt har et karbonatom i sin struktur.
- Den har en PKA på 3,77, mer syre enn eddiksyre, som kan forklares fordi metylgruppen gir elektronisk tetthet til det oksiderte karbonatomet med de to oksygenene. Dette resulterer i en liten nedstigning i surheten til protonet (CH3COOH, HCOOH).
- Usvarlig syren, dette blir Anion HCOO -formatet-, som kan demosiere den negative belastningen mellom de to oksygenatomene. Derfor er det en stabil anion og forklarer den store surheten i maursyre.
Reaksjoner
Maursyre kan dehydreres i karbonmonoksid (CO) og vann. I nærvær av platinakatalysatorer kan det også dekomponere i molekylært hydrogen og karbondioksid:
HCOOH (L) → H2(g) + co2(g)
Denne egenskapen gjør det mulig å betraktes som en trygg måte å lagre hydrogen.
Bruk av maursyre/applikasjoner
Mat- og landbruksnæringen
Til tross for hvor skadelig maursyre kan være, brukes den ved tilstrekkelige konsentrasjoner som konserveringsmiddel i mat på grunn av dens antibakterielle virkning. Av samme grunn brukes det i landbruket, hvor den også har en plantevernmidler.
Det presenterer også konserveringsmessige handlinger på beite, noe som hjelper til med å forhindre tarmgasser i avlsdyr.
Tekstil- og fottøyindustrien
Det brukes i tekstilindustrien innen farging og foredling av tekstiler, kanskje den hyppigste bruken av denne syren.
Maursyre brukes i lærbehandling på grunn av dens elendige virkning og i hårets eliminering av dette materialet.
Trafikksikkerhet på veier
I tillegg til den indikerte industrielle bruksområder, brukes de som er avledet fra format (formater) i Sveits og Østerrike på veier om vinteren, for å redusere risikoen for ulykker. Denne behandlingen er mer effektiv enn bruk av vanlig salt.
Referanser
- Tellus (1988). Atmosfærisk formisk fra Formicine Ants: A Preliminary Assessment408, 335-339.
- B. Hirse et al. (2015). Kilder og vasker av atmosfærisk maursyre. Atmos. Chem. Phys., 15, 6283-6304.
- Wikipedia. (2018). Maursyre. Innhentet fra.Wikipedia.org
- Aktiv. Maursyre. Gjenopprettet fra Actipedia.org
- Dr. N. K. Patel. Modur: 2, forelesning: 7. Maursyre. Nptel kom seg.Ac.i
- Jean og Fred. (14. juni 2017). Forlater haugene. [Figur]. Gjenopprettet fra: Flickr.com

