Hypoklorsyre (HCLO) struktur, egenskaper, bruksområder, syntese
- 4414
- 1184
- Jonathan Moe
Han Hypoklorsyre Det er en uorganisk forbindelse hvis kjemiske formel er Hclo. Det tilsvarer minst rustne av klor oksoacids, fordi det bare inneholder ett oksygenatom. Fra ham henter hypoklorittanionen, CLO-, og saltene, mye brukt som desinfeksjonsmidler for kommersielle vann.
HClo er det sterkeste oksidasjons- og antimikrobielle middelet enn det som er generert når gassformig klor oppløses i vann. Den antiseptiske virkningen har vært kjent i mer enn et århundre, selv før klorløsninger ble brukt til å rengjøre sårene til soldater i første verdenskrig.
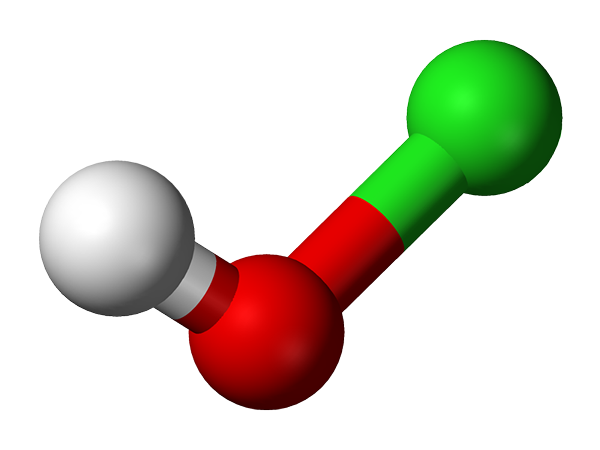
 Hypoklorous syremolekyl representert med en kuler og bars -modell. Kilde: Ben Mills og Jynto [Public Domain]
Hypoklorous syremolekyl representert med en kuler og bars -modell. Kilde: Ben Mills og Jynto [Public Domain] Hans de facto -oppdagelse stammer fra 1834 av den franske kjemikeren Antoine Jérôme Balard, som oppnådde den delvise oksidasjonen av klor som boblet den i en vandig suspensjon av kvikksølvoksid, HGO. Siden den gang har det blitt brukt som et desinfeksjonsmiddel og et antiviralt middel.
Kjemisk sett er HCLO et oksidasjonsmiddel som ender opp med å gi kloratomet til andre molekyler; Det vil si at klorerte forbindelser med ham kan syntetiseres, å være kloraminer med stor relevans i utviklingen av nye antibiotika.
På 70 -tallet ble det oppdaget at kroppen er i stand til naturlig å produsere denne syren gjennom virkningen av myeloperoxidase -enzymet; enzym som virker på peroksider og kloridanioner under fagocytose. Fra samme organisme kan denne "morderen" av inntrengerne oppstå, men i en ufarlig skala for sin egen velvære.
[TOC]
Struktur
Hclo -strukturen viser i det øvre bildet. Merk at formelen motsier strukturen: molekylet er H-O-CL og ingen H-Cl-O; Imidlertid foretrekkes det sistnevnte å kunne sammenligne det direkte med sine mest oksiderte kolleger: HCLO2, Hclo3 Og hclo4.
 Kjemisk struktur av hypoklorsyre.
Kjemisk struktur av hypoklorsyre. Syrehydrogen, H+, Utgitt av HClo ligger i OH -gruppen koblet til kloratom. Legg merke til de bemerkelsesverdige lengdeforskjellene i O-H- og CL-O-koblingene, og sistnevnte er den lengste på grunn av den lavere graden av overlapping av klorbaner, mer diffus, med oksygen.
HOCL -molekylet kan knapt forbli stabilt under normale forhold; Det kan ikke isoleres fra de vandige oppløsninger uten uforholdsmessig eller frigjøring som en gassformig klor, CL2.
Derfor er det ingen vannfrie krystaller (ikke engang hydrater av dem) av hypoklorsyre; Og til dags dato er det ingen indikasjoner på at de kan utarbeides ved ekstravagante metoder. Hvis for å krystallisere, ville Hclo -molekyler samhandle med hverandre gjennom sine permanente dipoler (orientert negativ belastning mot oksygen).
Det kan tjene deg: Cyclohexen: Struktur, egenskaper, syntese og brukEgenskaper
Surhet
Hclo er en monoprotisk syre; Det vil si at du bare kan donere en h+ til det vandige miljøet (som er her det dannes):
Hclo (ac) + h2Eller ↔ clo-(AC) + H3ENTEN+(AC) (PKA = 7.53)
Fra denne likevektsligningen observeres det at en reduksjon i H -ioner3ENTEN+ (En økning i miljøets grunnleggende-. Følgelig, hvis du vil holde en løsning av CLO relativt stabil- Det er nødvendig at pH er grunnleggende, som oppnås med NaOH.
Dissosiasjonskonstanten, PKA, er klar over at Hclo er en svak syre. Derfor, når du manipulerer det konsentrert, bør vi ikke bekymre oss så mye for H -ioner3ENTEN+, men av selve HCLO (gitt dens høye reaktivitet og ikke ved korrosivitet).
Oksidasjonsmiddel
Det ble nevnt at kloratom i HClo har et oksidasjonsnummer på +1. Dette betyr at det knapt krever gevinst av et enkelt elektron for å gå tilbake til basaltilstanden (CL0) og å kunne danne CL -molekylet2. Følgelig vil HCLO bli redusert til CL2 og h2Eller, oksiderende en annen art raskere sammenlignet med samme CL2 eller clo-:
2HCLO (AC) + 2H+ + 2e- ↔ Cl2(g) + 2H2Eller (l)
Denne reaksjonen lar deg skimte hvor stabil HClo i sine vandige oppløsninger.
Dens oksidasjonskraft måles ikke bare ved dannelse av CL2, men også for hans evne til å gi fra seg kloratom. For eksempel kan du reagere med nitrogenarter (inkludert ammoniakk og nitrogenbaser), for å forårsake kloraminer:
HClo + N-H → N-CL + H2ENTEN
Merk at en N-H-kobling, en aminogruppe (-NH er ødelagt (-NH2) mest, og erstattes av en N-CL. Det samme gjelder O-H-bindingene til hydroksylgrupper:
Hclo + O-H → O-CL + H2ENTEN
Disse reaksjonene er avgjørende og forklarer desinfeksjonsmiddelet og antibakteriell virkning av HCLO.
Stabilitet
Hclo er ustabil nesten der han ser ut. For eksempel er hypoklorittanion uforholdsmessig i klorarter med oksidasjonstall på -1 og +5, mer stabilt enn +1 i HCLO (H+Cl+ENTEN2-):
3cl-(AC) ↔ 2cl-(AC) + CLO3-(AC)
Denne reaksjonen ville bevege balansen mot HCLOs forsvinning. HClo deltar også direkte i en parallell balanse med vann og klorgass:
Kan tjene deg: fusjonCl2(g) + h2Eller (l) ↔ hclo (ac) + h+(AC) + CL-(AC)
Det er grunnen til at det å prøve å varme opp en HClo -løsning for å konsentrere den (eller isolere den) fører til produksjon av CL2, som identifiseres ved å være en gul gass. På samme måte kan ikke disse løsningene bli utsatt for lys for lenge, eller for tilstedeværelsen av metalloksider, når de bryter ned CL2 (Hclo forsvinner enda mer):
2cl2 + 2H2O → 4HCl + O2
HCl reagerer med Hcllo for å generere mer CL2:
HClo + HCl → CL2 + H2ENTEN
Og så videre til det er mer hclo.
Syntese
Vann og klor
En av metodene for å fremstille eller syntetisere hypoklorsyre er allerede implisitt forklart: oppløsende gassformig klor i vann. En annen ganske lik metode er å oppløse i vann Anhydridet til denne syren: Dichloro Monoxide, CL2ENTEN:
Cl2Eller (g) + h2Eller (l) ↔ 2hclo (AC)
Igjen er det ingen måte å isolere den rene Hclo, da det fordamper vannet vil fortrenge balansen til dannelsen av CL2Eller, gass som ville rømme fra vann.
På den annen side har det vært mulig å fremstille mer konsentrerte løsninger av HClo (ved 20%) ved bruk av kvikksølvoksid, HGO. For å gjøre dette, oppløses klor i et volum vann bare ved frysepunktet, slik at klorert is oppnås. Deretter blir denne samme isen omrørt, og mens den smelter, blandes den med HGO:
2cl2 + HGO + 12H2O → 2HCLO + HGCL2 + 11H2ENTEN
20% HCLO -oppløsning kan endelig destilleres i et vakuum.
Elektrolyse
En enklere og tryggere metode for å fremstille hypoklorsyreoppløsninger er å bruke salmuelas som råstoff i stedet for klor. Salmuerasene er rike på kloridanioner, CL-, som gjennom en elektrolyseprosess kan oksidere2:
2H2O → o2 + 4H+ + 4e-
2cl- ↔ 2e- + Cl2
Disse to reaksjonene forekommer i anoden, der klor som umiddelbart oppløses for å stamme HCLO produseres; Mens du er i katodeklokalet, reduseres vannet:
2H2O + 2E- → 2OH- + H2
På denne måten kan HCLO i en reklamefilm til industriell skala syntetiseres; Og disse løsningene hentet fra salmueras er faktisk produktene som er tilgjengelige i markedet for denne syren.
applikasjoner
Generelle funksjoner
HCLO kan brukes som et oksidasjonsmiddel for å oksidere alkoholer til ketoner, og for å syntetisere kloraminer, kloramider eller hydrokloriner (fra og med alkener).
Imidlertid kan alle andre bruksområder omfattes av et ord: Biocida. Han er en sopp, bakterier, virus og giftstoffer frigjort av patogener.
Det kan tjene deg: maleico syre: struktur, egenskaper, innhenting, brukImmunsystemet i kroppen vår syntetiserer sin egen Hclo ved virkningen av myeloperoxidase -enzymet, og hjelper hvite blodlegemer til å utrydde inntrengerne som forårsaker infeksjonen.
Infiniteter av studier foreslår ulike mekanismer for HClo -handling på den biologiske matrisen. Dette donerer kloratomet til aminogruppene av visse proteiner, og oksiderer også SH-gruppene deres til stede til S-S-disulfider, noe som resulterer som denaturering av dem.
Det stopper også DNA -replikasjon ved å reagere med nitrogenbaser, det påvirker fullstendig oksidasjon av glukose, og kan også deformere cellemembranen. Alle disse handlingene ender opp med å forårsake død for bakterier.
Desinfeksjon og rengjøring
Det er grunnen til at HCLO -løsninger ender opp med å bli brukt til:
-Behandling av smittsomme og gangrenas sår
-Desinfiser vannforsyning
-Steriliseringsmiddel for kirurgisk materiale, eller verktøy som brukes i veterinær, medisin og tannbehandling
-Desinfeksjonsmiddel av alle typer overflate eller objekter generelt: barer, rekkverk, kaffemaskiner, keramikk, glassbord, laboratorievern, etc.
-Syntetisere kloraminer som fungerer som mindre aggressive antibiotika, men samtidig mer holdbar, spesifikk og stabil enn HCLO selv
Risiko
Hclo -løsninger kan være farlige hvis de er veldig konsentrerte, siden de kan reagere voldsomt med arter som sannsynligvis vil oksidere. I tillegg har de en tendens til å frigjøre gassformig klor ved å destabilisere, så de må lagres under en streng sikkerhetsprotokoll.
Hclo er så reaktiv mot bakteriene, at der den er vannet forsvinner i handlingen, uten å representere en risiko senere for de som berører overflatene som behandles av ham. Det samme skjer inne i organismen: det brytes raskt ned, eller nøytraliseres av noen arter av det biologiske miljøet.
Når organismen i seg selv genererer, er det antatt at dette tåler lave konsentrasjoner av HCLO. Imidlertid, hvis det er veldig konsentrert (brukt til syntetiske og ikke -disinfeksjonsmessige formål), kan det føre til uønskede effekter ved også å angripe sunne celler (for eksempel hud).
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Gottardi, w., Debabov, d., & Nagl, m. (2013). N-kloraminer, en lovende klasse av vel tilknyttet aktuelle anti-infektiver. Antimikrobielle midler og cellegift, 57 (3), 1107-1114. Doi: 10.1128/AAC.02132-12
- Av Jeffrey Williams, Eric Rasmussen & Lori Robins. (6. oktober 2017). Hypoklorsyre: å utnytte en medfødt respons. Gjenopprettet fra: infeksjonskontroll.Tips
- Hydroinstrumenter. (s.F.). Grunnleggende kjemi for klorering. Hentet fra: Hydroinstritt.com
- Wikipedia. (2019). Hypoklorsyre. Hentet fra: i.Wikipedia.org
- Serhan Sakarya et al. (2014). Hypoklorsyre: Et ideelt sårpleiemiddel med kraftig mikrobicid, antibiofilm og sårhelende styrke. HMP -sår. Gjenopprettet fra: WoundsResearch.com
- Prebchem. (2016). Forberedelse av hypoklorsyre. Gjenopprettet fra: Prepchem.com
- « 15 fordeler med epler for fysisk og mental helse
- Jordens magnetfelt opprinnelse, egenskaper, funksjon »

