Hyposulfurous acid
- 1329
- 127
- Daniel Skuterud
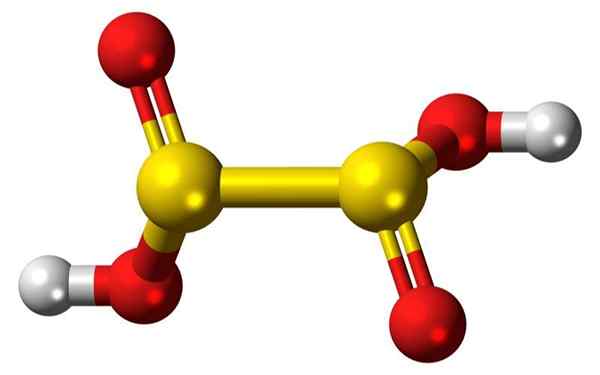
 3D -barer og ballonger av et hyposulfurersyremolekyl. Kilde: Jynto
3D -barer og ballonger av et hyposulfurersyremolekyl. Kilde: Jynto Hva er hyposulfurous acid?
Han Hyposulfurous acid, O dioninsyre, det er ukjent, ustabil rent, den har ingen uavhengig eksistens og har ikke blitt påvist i vandig løsning.
Teoretisk sett ville det være en relativt svak syre, sammenlignbar med svovelsyre, H2SO3. Bare saltene deres er kjent, Dionitos, som er stabile og er kraftige reduksjonsmidler. Natriumdioninsyresaltet er natriumdionito.
Formler
Hyposulfurous acid -formler er som følger:
Dioninsyre: H2S2ENTEN4
Dionito Anion: S2O42−
Natrium dionito: na2S2ENTEN4
CAS -nummer: 20196-46-7 Hyposulfurous acid (eller Dital)
CAS -nummer: 14844-07-6 Hyposulfurosyre (eller disjon, ion)
CAS -nummer: 7775-14-6 natriumdionito (natriumnatrium av ditoreringssyre)
Fysiske og kjemiske egenskaper
- I natriumdionitosaltet er utseendet et krystallinsk, hvitt til gråaktig støv, med flak av en lett og svak svovel sitrongrønn.
- Molekylvekten til ditasjonssyren er 130.132 g/mol. Dionito Anion, 128.116 g/mol, og natriumdionito, 174.096 g/mol.
- Ved kokepunktet til natriumdionito, dekomponerer det, og smeltepunktet er 52 ° C.
- Tettheten av natriumdionito er 2.38 g/cm³ (vannfri), og dens løselighet i vann er 18.2 g/100 ml (vannfri, 20 ° C).
- Hyposulfurous acid er en svovel oksoacid med den kjemiske formelen H2S2ENTEN4.
- Svovel oksoacids er kjemiske forbindelser som inneholder svovel, oksygen og hydrogen. Noen av dem er imidlertid bare kjent for saltene sine (for eksempel hyposulfurosyre, ditionsyre, disulfidsyre og svovelsyre).
Det kan tjene deg: pyridin: struktur, egenskaper, bruk, toksisitet, synteseBlant de strukturelle egenskapene til oksoacids har vi:
- Tetrahedral svovel når koordinert med oksygen.
- Oksygenatomer i bro og terminal.
- Periodinale grupper.
- S = s terminaler.
- Kjeder av (-s-) n
Svovelsyre er den mest kjente svoveloksiden.
- Dionito -anionen ([S2ENTEN4] 2-) er en oksoanion (et ion med den generiske formelen Axoy Z-) av svovel formelt avledet fra ditioninsyre.
- Dionito -ioner opplever både syre og alkalisk hydrolyse til tiosulfat og bisulfitt, og sulfitt og sulfid.
- Natriumdioninsyresaltet er natriumdionitt (også kjent som natriumhydrosulfitt).
- Det kan oppnås fra natriumbisulfitt gjennom følgende reaksjon:
2 Nahso3 + Zn → Na2SW4 + Zn (OH) ²
applikasjoner
Dionittionet brukes ofte i forbindelse med et komplekst middel (for eksempel sitronsyre), for å redusere jernoksi-hydroksyd (III) i oppløselige jernforbindelser (II) og eliminere de amorfe mineralfasene som inneholder jern (III) i jord Analyse (selektiv ekstraksjon).
Dionito gjør det mulig å øke jernløseligheten. Takket være den sterke affiniteten til Ion Dionito for bivalente og trivalente metallkationer, brukes den som et chelateringsmiddel.
Dionitos nedbrytning produserer reduserte svovelarter som kan være veldig aggressiv for korrosjon av stål og rustfritt stål.
Blant applikasjonene til natrium dionito har vi:
I bransjen
- Denne forbindelsen er et vannløselig salt, og kan brukes som et reduksjonsmiddel i vandige oppløsninger.
- Det brukes som sådan i noen industrielle fargestoffprosesser, hovedsakelig de som involverer svovelfargestoffer og karfargestoffer, der et vannoppløselig fargestoff kan reduseres til et vannoppløselig alkalisk metallsalt (for eksempel indigo -fargestoffet).
Kan tjene deg: syrer: egenskaper og eksempler- Natriumdionito reduksjonsegenskaper eliminerer også overflødig fargestoff, gjenværende oksid og uønskede pigmenter, og forbedrer dermed den globale fargen.
- Natriumdionito kan også brukes til vannbehandling, gassrensing, rengjøring og ekstraksjon. Det kan også brukes i industrielle prosesser som et sulfonantmiddel eller en natriumkilde.
- I tillegg til tekstilindustrien, brukes denne forbindelsen i lærrelaterte næringer, mat, polymerer, fotografering og mange andre. Det brukes også som et avfargingsmiddel i organiske reaksjoner.
I biologiske vitenskaper
- Natriumdionito brukes ofte i fysiologiske eksperimenter som et middel for å redusere redokspotensialet til løsninger.
I geologiske vitenskaper
- Natriumdionito brukes ofte i jordkjemieksperimenter for å bestemme mengden jern som ikke er inkorporert i primære silikatmineraler.
Sikkerhet og risiko
Manipulering av dette elementet må gjøres under ekstreme omsorgsforhold. Det er ekstremt giftig og kan reagere farlig i forbindelse med vann og luft.
Deretter fremhever vi noen aspekter.
Luft- og vannreaksjoner
- Natriumdionito er et fast drivstoff som dekomponerer sakte når det er i kontakt med vann eller vanndamp, og danner tiosulfater og bisulfitter.
- Denne reaksjonen produserer varme, som ytterligere kan akselerere reaksjonen eller få de omkringliggende materialene til å brenne. Hvis blandingen er innesperret, kan nedbrytningsreaksjonen resultere i presset av beholderen, som kan brytes sterkt. Når du blir igjen i luften, oksiderer den sakte, og genererer giftig svoveldioksidgasser.
Kan tjene deg: Nitrofurans: Kjennetegn, handlingsmekanisme og klassifiseringBrannfare
- Natriumdionito er et brennbart og brennbart materiale. Kan være betent på kontakt med våt luft eller fuktighet. Du kan raskt brenne med blusseffekt. Kan reagere kraftig eller eksplosivt i kontakt med vann.
- Kan brytes ned eksplosivt når det blir oppvarmet eller er involvert i en brann. Kan slå på igjen etter at brannen er slukket. Avrenning kan skape ild- eller eksplosjonsfare. Containere kan eksplodere når de blir oppvarmet.
Helsefare
- Når du kommer i kontakt med ild, vil natriumdionito produsere irriterende, etsende og/eller giftige gasser. Innånding av nedbrytningsprodukter kan forårsake alvorlige skader eller død. Kontakt med stoffet kan forårsake alvorlige forbrenninger på huden og øynene. Brannkontrollavrenning kan forårsake forurensning.
Referanser
- Benjah-BMM27 (2006). En ball-og-pinne-modell av det dithionite-ion [image] utvunnet fra.Wikipedia.org.
- Mills, f. (2009). Natrium-ditionitt -estalt-1992-3d-balls [bilde] utvunnet fra: i.Wikipedia.org.

