Selenhydrric acid (H2SE) hva er, struktur, egenskaper, bruk
- 3792
- 714
- Markus Fredriksen
 Hydrogen Seleniuro: To hydrogenmolekyler og ett av selen
Hydrogen Seleniuro: To hydrogenmolekyler og ett av selen Hva er selenhydrisk syre?
Han Selenhydrikkyre o Hydrogen seleniuro er en uorganisk forbindelse hvis kjemiske formel er h2HAN. Det er av kovalent karakter, og under vanlig temperatur- og trykkforhold er det en fargeløs gass; Men med en sterk gjenkjennelig lukt av sin mindre tilstedeværelse. Kjemisk er det en traktat, så selen har Valencia på -2 (i2-).
Av alle selenuros, h2Det er det mest giftige fordi molekylet er lite og dets selenatom har mindre sterisk hindring når du reagerer. På den annen side lar lukten de som jobber med den å oppdage den i handlingen i tilfelle en utenfor laboratorieklokken.
Hydrogen seleniuro kan syntetisere ved den direkte kombinasjonen av de to elementene: molekylært hydrogen, h2, og metallisk selen. Det kan også oppnås ved å oppløse forbindelser rike på selen, så som jern seleniuro (II), Fese, i saltsyre.
På den annen side tilberedes selenhydrikkyre ved å løse opp hydrogen seleniuro i vann; Det vil si at den første er oppløst i vannet, mens den andre består av brus.
Hovedbruken er å være en kilde til selen i organisk og uorganisk syntese.
Hydrogen seleniuro -struktur
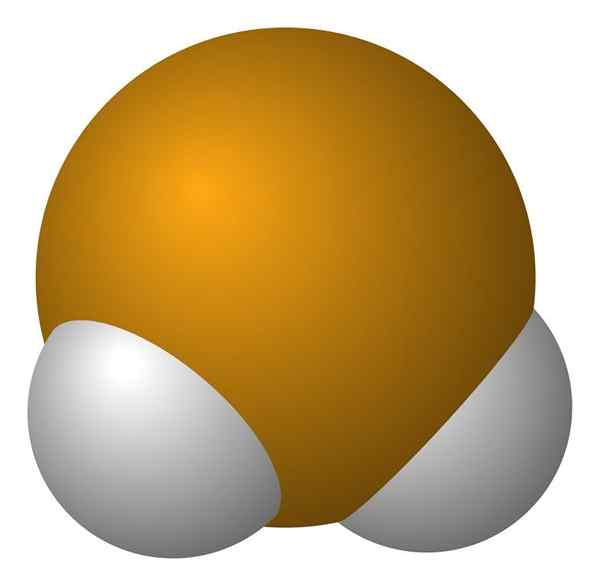
 Hydrogen seleniuro -molekyl. Wikimedia Commons.
Hydrogen seleniuro -molekyl. Wikimedia Commons. H -molekulaen2Det er av vinkelgeometri, selv om dens vinkel på 91 ° får den til å se mer ut som en L enn for en V. I denne modellen av sfærer og barer er hydrogenatomer og selen de hvite og gule sfærene.
Dette molekylet, som vist, er det som er i en gassfase; det vil si for hydrogen seleniuro. Når du oppløses i vann, frigjør det en proton og i løsning har du par HMS- H3ENTEN+; Dette ionemomentet kommer til selenhydronsyre, betegnet som h2Se (ac) for å skille det fra hydrogen seleniuro, h2Se (g).
Kan tjene deg: metylenblått: egenskaper, forberedelser, bruk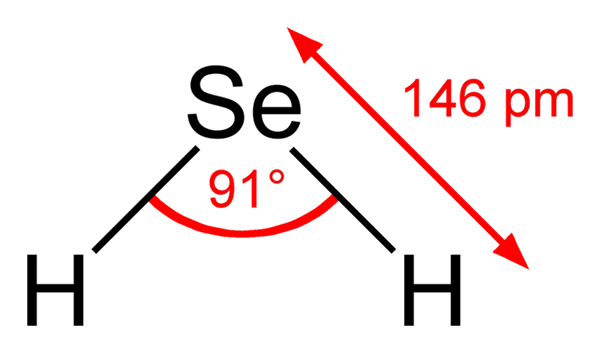 Strukturell formel av seleenhydronsyre. Ben Mills, Wikimedia Commons ..
Strukturell formel av seleenhydronsyre. Ben Mills, Wikimedia Commons .. Derfor strukturer mellom h2Se (ac) og h2Se (g) er veldig forskjellige; Den første er omgitt av en vandig sfære og har ioniske belastninger, og den andre består av et agglomerat av gassfasemolekyler.
H -molekylene2De kan knapt samhandle med hverandre gjennom veldig svake krefter Dipolo-Dipolo. Selen, selv om det er mindre elektronegativ enn svovel konsentrerer større elektronisk tetthet for å "snappe det" fra hydrogenatomer.
Selenio hydrues komprimert
Hvis H -molekyler2De gjennomgår ekstraordinært press (hundrevis av GPA), teoretisk sett blir de tvunget til å stivne ved å danne SE-H-SE-koblinger; Dette er koblinger til tre sentre og to elektroner (3C-2E) der hydrogen deltar. Derfor begynner molekyler å danne polymerstrukturer som definerer et fast stoff.
Under disse forholdene kan det faste stoffet med mer hydrogen berikes, noe som fullstendig endrer de resulterende strukturer. I tillegg blir komposisjonen type hnSE, der N varierer fra 3 til 6. Dermed har selenhydrider komprimert av disse trykket, og i nærvær av hydrogen, har kjemiske formler H3Jeg vet h6HAN.
Det anslås at disse selenhydrorene beriket med hydrogen har superledende egenskaper.
Egenskaper
Fysisk utseende
Fargeløs gass som ved lave temperaturer lukter putrefacto og råtne egg hvis konsentrasjonen øker. Lukten er verre og mer intens enn hydrogensulfid (som allerede er ganske ubehagelig). Dette er imidlertid bra, siden det hjelper sin enkle deteksjon og reduserer langvarig kontakt eller inhalasjonsrisiko.
Når det brenner, gir det et blåaktig flammeprodukt av elektroniske interaksjoner i selenatomer.
Kan tjene deg: svoveloksidMolekylmasse
80,98 g/mol.
Kokepunkt
-41 ° C.
Smeltepunkt
-66 ° C.
Damptrykk
9,5 atm ved 21 ° C.
Tetthet
3.553 g/l.
Pktil
3.89.
Vannløselighet
0,70 g/100 ml. Dette bekrefter det faktum at selenatomet av H2Du kan ikke danne hydrogenbroer som er betydelig med vannmolekyler.
Løselighet i andre løsningsmidler
-Løselig i CS2, Noe som ikke er overraskende av den kjemiske analogien mellom selen og svovel.
-Phosgen løselig (ved lave temperaturer, da det koker ved 8 ° C).
Nomenklatur
Som forklart i tidligere seksjoner, varierer navnet på denne forbindelsen avhengig av om h2Det er i en brus eller oppløst fase i vann. Når det er i vann, er det snakk om seleenhydronsyre, som ikke er noe mer enn en hydrati i uorganiske termer. I motsetning til gassmolekyler, er den sure karakteren større.
Enten som gass eller oppløst i vann, opprettholder imidlertid selenatom de samme elektroniske egenskapene; For eksempel er Valencia -2, med mindre du lider av en oksidasjonsreaksjon. Denne Valencia på -2 er grunnen til at det kalles seleniAurochs av hydrogen, siden seleniuro -anionen er2-; som er mer reaktiv og reduserer enn S2-, sulfid.
Hvis systematisk nomenklatur brukes, må antallet hydrogenatomer i forbindelsen spesifiseres. Dermed h2Det kalles: seleniuro av gahydrogen.
Seleniuro eller hydrid?
Noen kilder omtaler ham som et hydrid. Hvis det virkelig var, ville selenet ha positiv ladning +2, og den hydrogen negative belastningen -1: SEH2 (HAN2+, H-). Selen er et mer elektronegativt atom enn hydrogen, og ender derfor "monopoliserer" den høyeste elektroniske tettheten i H -molekylet2HAN.
Kan tjene deg: termokjemiSom sådan kan imidlertid eksistensen av selenhydrid ikke kastes. Faktisk, med tilstedeværelsen av H -anioner- Det ville lette SE-H-SE-koblinger, ansvarlig for faste strukturer som er dannet til et stort trykk i henhold til datastudier.
applikasjoner
Metabolsk
Selv om det virker motstridende, til tross for den store toksisiteten til H2SE, den produseres i kroppen på selenens metabolske rute. Imidlertid produseres cellene knapt som en mellomledd i syntium av selenioproteiner, eller ender opp med å bli metylert og skilles ut; Et av symptomene på dette er hvitløkssmaken i munnen.
Industriister
H2Det brukes hovedsakelig til å tilsette selenatomer til faste strukturer, for eksempel halvledermaterialer; til organiske molekyler, for eksempel alkener og nitriler for syntese av organiske selenuros; eller til en løsning for å presipitere metalliske selenuros.
Referanser
- Hydrogen selenid. Hentet fra: i.Wikipedia.org
- Hydrogen selenid, h2HAN. Gjenopprettet fra: Selenium.Atomistry.com

