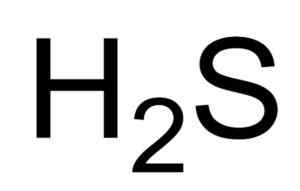
Sulfhydronsyre (H2S) struktur, egenskaper, bruksområder, betydning
- 2631
- 509
- Theodor Anders Hopland
Han sulfhydrikkyre O Hydrogensulfid er en gass dannet av foreningen av et svovelatom (er) og to hydrogenatomer (H). Dens kjemiske formel er h2S. Det er også kjent som sulfidgass. Det er en fargeløs gass hvis lukt blir tydelig i råtne egg.
Det er til stede i vulkaner og svovelholdige kilder, i naturgass og råolje. Det dannes også under anaerob (uten oksygen) nedbrytning av organisk plante og dyr. Det forekommer naturlig i kroppen av pattedyr, gjennom virkningen av visse enzymer på cystein, en ikke -essensiell aminosyre.
 Kjemisk formel av sulfhydronsyre eller hydrogensulfid. Saranphong Yimklan [Public Domain]. Kilde: Wikimedia Commons.
Kjemisk formel av sulfhydronsyre eller hydrogensulfid. Saranphong Yimklan [Public Domain]. Kilde: Wikimedia Commons. De vandige oppløsningene av H2S er etsende for metaller som stål. H2S er en reduserende forbindelse som når du reagerer med SO2 , Det oksiderer elementær svovel mens du reduserer til SO2 Også til svovel.
Til tross for at han er en svært giftig og dødelig forbindelse for mennesker og dyr, har dens betydning i noen år blitt studert i en serie viktige prosesser i kroppen.
Regulerer en serie mekanismer relatert til generering av nye blodkar og hjertets funksjon.
Beskytte nevroner og har tenkt på dens handling mot sykdommer som Parkinson og Alzheimers.
På grunn av den kjemiske reduksjonen kan bekjempe oksiderende arter, og dermed virker mot celle aldring. På grunn av disse årsakene blir muligheten for å produsere medisiner studert at når de leveres til pasienter sakte kan frigjøre det i kroppen.
Dette vil tjene til å behandle patologier som iskemi, diabetes og nevrodegenerative sykdommer. Imidlertid må deres handlingsmekanisme og deres sikkerhet fortsatt undersøkes i dybden.
[TOC]
Struktur
H -molekulaen2S er analog med vannet, det vil si at de ligner formen fordi hydrogener er lokalisert og danner en vinkel med svovel.
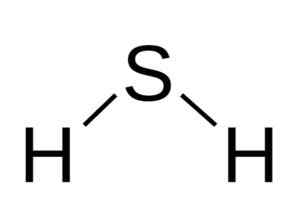 Vinkelstruktur av sulfidsyremolekylet, H2S. Bangin [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons.
Vinkelstruktur av sulfidsyremolekylet, H2S. Bangin [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons. Svovel i h2S har følgende elektroniske konfigurasjon:
1s2, 2s2 2 s6, 3s2 3p6,
Ta deretter et elektron av hvert hydrogen for å fullføre valenslaget.
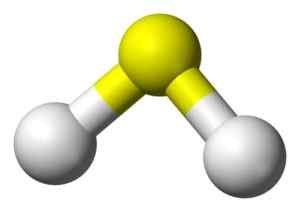 3D -struktur av sulfidsyre. Gul: svovel. Hvitt: Hydrogen. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
3D -struktur av sulfidsyre. Gul: svovel. Hvitt: Hydrogen. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. Nomenklatur
- Sulfhydrikkyre
- Hydrogensulfid
- Svovelhydrid.
Fysiske egenskaper
Fysisk tilstand
Fargeløs gass av veldig ubehagelig lukt.
Molekylær vekt
34,08 g/mol.
Smeltepunkt
-85,60 ºC.
Kokepunkt
-60,75 ºC.
Tetthet
1.1906 g/l.
Løselighet
Moderat vannløselig: 2,77 volum i 1 vann ved 20 ºC. Det kan kastes fra den vandige løsningen fullstendig ved å sende den til koke.
Kjemiske egenskaper
I vandig løsning
Når hydrogensulfid er i vandig oppløsning, tildeles sulfhydrisksyre navnet. Det er en svak syre. Den har to ioniserbare protoner:
H2S + H2Eller ⇔ h3ENTEN+ + HS-, KA1 = 8,9 x 10-8
HS- + H2Eller ⇔ h3ENTEN+ + S2-, KA2 ∼ 10-14
Det første protonet er lett ionisert, som kan trekkes ut fra den første ioniseringskonstanten. Den andre protonen er veldig lite ionisert, men Hs løsninger2S inneholder noe av svovelanionen2-.
Hvis H -løsningen2S blir utsatt for luften, o2 Oxida til sulfidanion og svovel presipitater:
Kan tjene deg: oksider2 s2- + 4 H+ + ENTEN2 → 2 timer2O + 2 s0↓ (1)
I nærvær av klor CL2, Bromo Br2 og jod i2 Tilsvarende hydrogen og svovel dannes:
H2S + Br2 → 2 HBR + S0↓ (2)
De vandige oppløsningene av H2S er etsende, produserer stresssprekker med sulfid i høye harde stål. Korrosjonsprodukter er jern og hydrogensulfid.
Oksygenreaksjon
H2S reagerer med oksygenet i luften og følgende reaksjoner kan oppstå:
2 h2S + 3 o2 → 2 timer2O + 2 Så2 (3)
2 h2S + o2 → 2 timer2O + 2 s0↓ (4)
Reaksjon med metaller
Den reagerer med forskjellige metaller som beveger seg til hydrogen og danner metallsulfid:
H2S + PB → PBS + H2↑ (5)
Reaksjon med svoveldioksid
I de vulkanske gassene er h til stede2S og SO2, som reagerer med hverandre og solid svovel dannes:
H2S + Så2 → 2 timer2O + 3 s0↓ (6)
Nedbrytning med temperatur
Hydrogensulfid er ikke veldig stabilt, det brytes lett ved oppvarming:
H2S → H2↑ + S0↓ (7)
Plassering i naturen
Denne gassen finnes naturlig i sulfidiske eller sulfurøse varme kilder, i vulkanske gasser, i råolje og naturgass.
 Svovelholdig vann manantisk. Николай макимович [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons.
Svovelholdig vann manantisk. Николай макимович [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons. Når olje (eller gass) inneholder betydelige spor av h2S sies å være "sur", i motsetning til "søt", det er når den ikke inneholder det.
Små mengder h2S i olje eller gass er økonomisk skadelig fordi et vaskeanlegg må installeres for å fjerne det, både for å forhindre korrosjon og for å gjøre gjenværende gass trygt for husholdning som drivstoff.
Det oppstår når det organiske stoffet som inneholder svovel blir dekomponert under anaerobe forhold (fravær av luft), som mennesker, dyr og planteavfall.
 H -utslipp2S (blåaktig grønn farge) på kysten av Namibia, fotografert av NASA. Disse utslippene kommer fra organisk avfall. NASAs Earth Observatory [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)]. Kilde: Wikimedia Commons.
H -utslipp2S (blåaktig grønn farge) på kysten av Namibia, fotografert av NASA. Disse utslippene kommer fra organisk avfall. NASAs Earth Observatory [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)]. Kilde: Wikimedia Commons. Bakteriene som er til stede i munnen og i mage -tarmkanalen produserer den fra de nedbrytbare materialene som grønnsaker eller animalsk proteiner inneholder.
Den karakteristiske lukten fører til at dens tilstedeværelse i råtne egg blir advart.
H2S Det forekommer også i visse industrielle aktiviteter, for eksempel i oljeraffinerier, koksovner, papirfabrikker, ville du ha og i matforedling.
Syntese i kroppen av pattedyr
H2S endogent kan forekomme i pattedyrvev, blant disse menneskene, av to stier, en enzymatisk og en ikke -enzymatisk en.
Den ikke -enzymatiske banen består i å redusere elementær svovel s0 til h2S gjennom glukoseoksidasjon:
2 c6H12ENTEN6 (glukose) + 6 s0 (svovel) + 3 timer2O → 3 c3H6ENTEN3 + 6 timer2S + 3 CO2 (8)
Kan tjene deg: klor: historie, egenskaper, struktur, risiko, brukDen enzymatiske banen består av h h2S fra L-Cystein, som er en aminosyresyntetisert av kroppen. Prosessen er forsikret av flere enzymer, for eksempel cystasjon.
 Sulfhydronsyre er funnet i hjernen til kyr. Forfatter: Arttower. Kilde: Pixabay.
Sulfhydronsyre er funnet i hjernen til kyr. Forfatter: Arttower. Kilde: Pixabay. Innhenting i laboratoriet eller industrielt
Hydrogengass (h2) og svovelelementet (e) reagerer ikke på normale miljøtemperaturer, men over disse begynner de å bli kombinert, den optimale temperaturen er 310 ºC.
Prosessen er likevel for treg, så andre metoder brukes til å få den, blant disse følgende.
Metallsulfider (for eksempel jernholdig sulfid) reagerer med syrer (for eksempel hydroklor) i fortynnet løsning.
FES + 2 HCl → FECL2 + H2S ↑ (9)
På denne måten oppnås gassen2S som, gitt dens toksisitet, må trygge samles inn.
Industriell bruk av H2S for å produsere svovel
Lagring og transport i store mengder h2S som skiller seg fra naturgass ved å vaske med aminer er vanskelig, så Claus -prosessen brukes til å gjøre den til svovel.
 I oljeraffineriene skilles H separert2S med naturgass ved å vaske med aminer og blir deretter svovel. Forfatter: Satyaprem. Kilde: Pixabay.
I oljeraffineriene skilles H separert2S med naturgass ved å vaske med aminer og blir deretter svovel. Forfatter: Satyaprem. Kilde: Pixabay. I denne prosessen oppstår to reaksjoner. I den første h2S reagerer med oksygen å gi det2, Som nevnt ovenfor (se reaksjon 3).
Den andre er en reaksjon katalysert av jernoksid der SO2 er redusert og h2S oksiderer, og de to produserer svovel (se reaksjon 6).
På denne måten oppnås svovel, som enkelt kan lagres og transporteres, samt tildeles flere bruksområder.
Nytte eller viktighet av h2S endogen i organismen
H2S endogen er den som forekommer naturlig i organismen som en del av den normale metabolismen hos mennesker, pattedyr og andre levende vesener.
Til tross for det langvarige rykte om å være en giftig og giftig gass assosiert med nedbrytning av organisk materiale, har flere nyere studier fra 2000 til nåtiden bestemt at H2S endogen er en viktig regulator av visse mekanismer og prosesser i levende vesen.
H2S presenterer høy lipofilisitet eller affinitet mot fett, så det krysser cellemembraner enkelt, og trenger gjennom alle typer celler.
Sirkulasjonssystem
Hos pattedyr fremmer eller regulerer sulfidsyre en serie signaler som regulerer metabolisme, hjertefunksjon og celleoverlevelse.
Det utøver en kraftig effekt på hjertet, blodkarene og sirkulerende blodelementer. Modulerer cellulær metabolisme og mitokondriell funksjon.
Forsvarer nyrene til skaden forårsaket av iskemi.
Gastrointestinal system
Spill en viktig rolle som en beskyttende faktor mot skade på mageslimhinnen. Det anslås å være en viktig formidler av gastrointestinal bevegelighet.
Det er sannsynlig at det er involvert i kontrollen av insulinsekresjon.
Sentralnervesystemet
Det virker også i viktige funksjoner i sentralnervesystemet og beskytter oksidativt stressneuroner.
 Nevroner er beskyttet av h2S endogent. Forfatter: Gerd Altmann. Kilde: Pixabay.
Nevroner er beskyttet av h2S endogent. Forfatter: Gerd Altmann. Kilde: Pixabay. Det anslås at det kan beskytte mot nevrodegenerative sykdommer som Parkinsons Parkinson, Alzheimers og Hungintons sykdom.
Visjonsorgan
Beskytte fotoreseptorceller mot retinal degenerasjon indusert av lys.
Det kan tjene deg: litiumkarbonat (Li2CO3): Struktur, egenskaper, brukMot aldring
H2Det å være en reduserende art kan konsumeres ved at en rekke oksidasjonsmidler som sirkulerer i kroppen. Bekjempe oksiderende arter som reaktive oksygenarter og reaktive nitrogenarter i kroppen.
Begrens reaksjonene fra frie radikaler gjennom aktivering av antioksidantenzymer som beskytter mot effekten av aldring.
Helbredende potensial for h2S leveres eksogent
Biotilgjengeligheten til h2S endogent avhenger av visse enzymer involvert i biosyntesen av cystein hos pattedyr.
Noen studier antyder at en donor donor doner2S kan være fordelaktig for visse patologier.
For eksempel kan det være nyttig hos diabetespasienter, siden det har blitt observert at blodkar av diabetiske dyr forbedrer seg med medisiner som leverer H2S eksogent.
H2S gitt eksogent øker angiogenese eller dannelse av blodkar, slik at det kan tjene til behandling av kroniske iskemisykdommer.
Det blir utviklet medisiner som kan frigjøre h2S sakte for å kunne handle fordelaktig om forskjellige sykdommer. Effektiviteten, sikkerhet og mekanismer for deres handling må imidlertid fortsatt undersøkes.
Risiko
H2S er en dødelig gift hvis den inhalerer ren eller til og med fortynnet 1 del av gassen i 200 deler luft. Fugler er veldig følsomme for H2S og dør selv i fortynning av 1 i 1500 deler av luften.
 Sulfidyre eller hydrogensulfid H2S er en kraftig gift. Forfatter: Openicons. Kilde: Pixabay.
Sulfidyre eller hydrogensulfid H2S er en kraftig gift. Forfatter: Openicons. Kilde: Pixabay. H2S er en kraftig hemmer av visse enzymer og oksidative fosforyleringsprosesser, noe som fører til cellens kvelning. De fleste oppfatter det olfitorly i konsentrasjoner større enn 5 ppb (deler per milliard). Konsentrasjonene på 20-50 ppm (deler per million) er irriterende for øynene og luftveiene.
En innånding av 100-250 ppm i noen minutter kan generere mangel på koordinering, hukommelsesforstyrrelser og motoriske lidelser. Når konsentrasjonen er omtrent 150-200 ppm2S. Hvis en konsentrasjon på 500 ppm inhaleres i 30 minutter, kan lungeødem og lungebetennelse produseres.
Konsentrasjoner på mer enn 600 ppm kan være dødelig i løpet av de første 30 minuttene, siden luftveiene er lammet. Og 800 ppm er konsentrasjonen som umiddelbart er dødelig for mennesket.
Derfor må det unngås at det er slipp fra H2S i laboratorier, lokalt eller hvor som helst eller situasjon.
Det er viktig å varsle at mange dødsfall oppstår fordi folk inngår rom som er begrenset til redningskolleger eller familiemedlemmer som har kollapset på grunn av forgiftning med H2S, dør dem også.
Det er en brennbar gass.
Referanser
- Panthi, s. et al. (2016). Fysiologisk betydning av hydrogensulfid: Emerging Potnt NeuroProtector and Neuromodulator. Oksidativ medisin og cellulær levetid. Volum 2016. Artikkel ID 9049782. Hyndawi kom seg.com.
- Shefa, u. et al. (2018). Antioksidant og cellesignaleringsfunksjoner av hydrogensulfid i sentralnervesystemet. Oksidativ medisin og cellulær levetid. Volum 2018. Artikkel ID 1873962. Hyndawi kom seg.com.
- Tabassum, r. et al. (2020). Terapeutisk betydning av hydrogensulfid i aldersassosierte nevrodegenerative sykdommer. Neural Regen Res 2020; 15: 653-662. Nrronline kom seg.org.
- Martelli, a. et al. (2010). Hydrogensulfid: Noval mulighet for funn av medikamenter. Medisinsk forskningsgjennomgang. Volum 32, utgave 6. Hentet fra online bibliotek.Wiley.com.
- Wang, m.-J. et al. (2010). Mekanismer for angiogese: Rollen til hydrogensulfid. Clinical and Experimental Pharmacology and Physiology (2010) 37, 764-771. Hentet fra online bibliotek.Wiley.com.
- Dalefield, r. (2017). Røyk og andre inhalerte toksikonter. Hydrogensulfid. I veterinærtoksikologi for Australia og New Zealand. Gjenopprettet fra Scientedirect.com.
- Selley, R.C. og Sonnenberg, S.TIL. (2015). De fysiske og kjemiske egenskapene til petroleum. Hydrogensulfid. I Elements of Petroleum Geology (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Hocking, m.B. (2005). Svovel og svovelsyre. Claus prosessomdannelse av hydrogensulfid til svovel. I Handbook of Chemical Technology and Pollution Control (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Lefer, d.J. (2008). Potensiell betydning av endringer i hydrogensulfid (h2S) Biooverførbarhet ved diabetes. British Journal of Pharmacology (2008) 155, 617-619. Hentet fra bpspubs.Online bibliotek.Wiley.com.
- ELLER.S. National Library of Medicine. (2019). Hydrogensulfid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov.
- Port, j.TIL. og Ibarz, J. (1965). Moderne generell kjemi. 7. utgave. Marín redaksjon, S.TIL.
- « Sosialistisk utdannings opprinnelse, egenskaper, prinsipper, eksempler
- Nyklassisk teaterhistorie, egenskaper, representanter, verk »

