Sulfámic acidstruktur, egenskaper, syntese, bruk
- 1692
- 63
- Mathias Aas
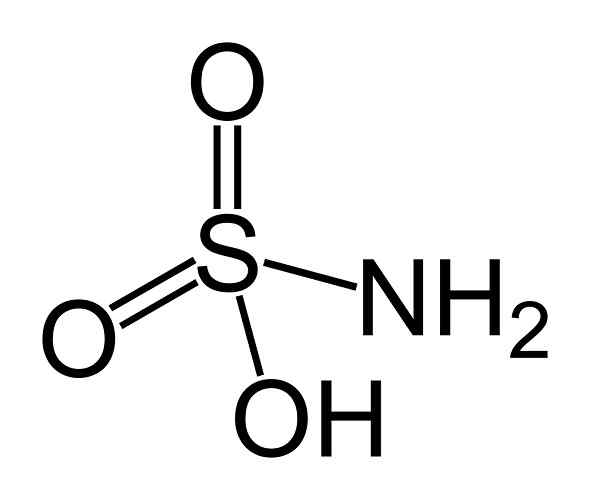
Han sulfaminsyre Det er en uorganisk forbindelse dannet av et atom av svovel (er) festet i en kovalent form og av enkel lenke til en hydroksylgruppe (-OH) og en aminogruppe (-NH2), og ved dobbeltbinding til to oksygenatomer (O). Det er et hvitt krystallinsk fast stoff. Den kjemiske formelen er NH2SW3H. Det er også kjent som aminosulfonsyre, amidosulfonsyre, amidosulfursyre og sulfamidsyre.
Sulfáminsyre er en sterk syre. Du kan reagere med metaller, metall- og karbonatoksider. Saltene er generelt oppløselige i vann, så det er en god fjerner av innlegg i prosessutstyr. Det brukes ofte i sukkerfabrikker for å rengjøre karbonatinnlegg i fordamper.
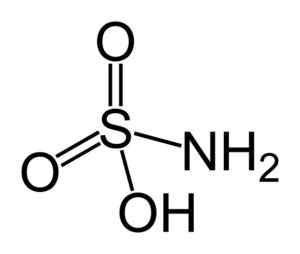 Sulfámic acid Structure. Benjah-BMM27 [Public Domain]. Kilde: Wikipedia Commons.
Sulfámic acid Structure. Benjah-BMM27 [Public Domain]. Kilde: Wikipedia Commons. Sulfámic acid er en nitritter redusering (nei2-) og denne kjemiske egenskapen brukes i flere applikasjoner, som i fargestoffindustrien og nitritesanalysen.
Den har bruk i lærbrannen og i bleking av massen til papirproduksjon. Det er faktisk en forurensning av mat, som den ofte finnes i papirene og kortene som brukes til å pakke dagligvarebutikkene.
Det brukes også i metallelektrode, som et laboratoriemønster, og et av derivater er et veldig effektivt ugressmiddel.
[TOC]
Struktur
Sulfaminsyre krystalliserer seg i form av bipiramidale ortorrombuskrystaller. Form kompakte prismer og ark når de krystalliserer fra kald løsning, så vel som rhombusark når det gjør det varmt vandig oppløsning.
Nomenklatur
- Sulfaminsyre
- Aminosulfonsyre
- Amidosulfonsyre
- Amidosulfurinsyre
- Sulfami -acid
Egenskaper
Fysisk tilstand
Hvit krystallinsk faststoff.
Molekylær vekt
97,1 g/mol.
Smeltepunkt
205 ºC, dekomponerer ved 209 ºC.
Tetthet
2,15 g/cm3
Løselighet
Løselig i vann:
- 12,8% til 0 ºC
- 17,57% ved 20 ºC
- 22,77% ved 40 ° C
Knapt løselig i metanol, litt oppløselig i aceton, uoppløselig i eter.
Fritt løselig i nitrogenbaser og organiske løsningsmidler som inneholder nitrogen.
Uoppløselig i karbondisulfid (CS2) og karbontetraklorid (CCL4).
Ph
0,41 (i løsning 1 n, det vil si 1 ekvivalent/l).
Dissosiasjonskonstant
0,101 til 25 ºC.
Kjemiske egenskaper
Det er en sterk syre. Nesten like mye som saltsyrer (HCl), nitrogen3) og svovel (h2SW4).
Kan tjene deg: oksygenerte forbindelser: egenskaper, reaksjoner, brukVandige sulfaminsyreoppløsninger er sterkt ionisert. PH er lavere enn løsningene av formiske, fosforiske og oksalsyrer.
I vann mister sulfaminsyre bare protonet som er bundet til oksygen. Nitrogen -førte hydrogener forblir godt forent.
I vandig løsning hydrolyseres det sakte for å gi ammoniumsyresulfat (NH4HSO4). Er stabil under tørre forhold.
Sulfámic acid angriper metaller, metalloksider og karbonater for å generere sulfamater. For eksempel med kaliummetall (K) kaliumsulfamat (Koso2NH2) og hydrogen (h2).
Alle sulfaminsyresalter er oppløselige i vann. Kalsium, bly- og bariumsalter er veldig oppløselige i vann, i motsetning til den tilsvarende svovelsyre.
Lystgallsyre (HNO2) reagere kvantitativt med aminogruppen av sulfaminsyre, frigjøre nitrogen (n2). Det anslås at sulfamationet fungerer i denne reaksjonen som en amida, ikke som amin.
Sulfáminsyre oksideres av klor, brom eller kaliumklorat for å omdanne det til svovelsyre. Denne reaksjonen forekommer ikke med andre oksidanter som kromsyre eller kaliumpermanganat.
Den er ikke kompatibel (reagerer) med sterke alkalier, klor, hypoklorsyre, hypokloritter, cyanider og sulfider.
Andre egenskaper
Det er ikke hygroskopisk (dette betyr at det ikke absorberer fuktigheten i luften).
Når den er oppvarmet til nedbrytning avgir meget giftige røyk av svoveloksider og hydrogenklorid (HCl).
Et av derivater, ammoniumsulfamat, er en brannhemmende.
Det er moderat giftig.
Syntese
Sulfámic acid oppnås ved urea co -reaksjon (NH2)2 Med røykende svovelsyre, det vil si svovelsyre (h2SW4) Konsentrat som inneholder svoveltrioksid (så3).
Det kan også syntetiseres ved å reagere klorosulfonsyre (Hclo3CL) og ammoniakk (NH3).
applikasjoner
I fargeleggingsbransjen
Sulfámic acid brukes til å fjerne overflødige nitritter raskt og effektivt i diazotiseringsreaksjoner i fargeleggingssyntese. Det er mye mer praktisk enn urea for dette formålet.
I lærbehandling
Under læring av lær gir bruk av sulfaminsyre i stedet for svovelsyre en tynnere og mer silkeaktig tekstur.
Kan tjene deg: metallmineralerI tillegg, siden kalsiumsulfamat er vannløselig, i motsetning til kalsiumsulfat, kan sulfámsyre brukes i den disenchanted prosessen uten å etterlate flekker som noen ganger oppstår i lær når det brukes svovelsyre når det brukes.
 Skinnsko. Kilde: Pixabay.
Skinnsko. Kilde: Pixabay. I rengjøringsprosessutstyr
Sulfámic acid brukes som en avkalkningsrenser i byller, reaktorer, rør, kjølesystemer og varmevekslere.
I dette utstyret blir inlays for sirkulasjon av vann eller forbindelser av prosessen i energianlegg, kjemiske anlegg, tilnærminger, papirfabrikker, kompresjonsstasjoner og andre bransjer dannet.
Inlays eller faste avsetninger kan være organiske (alger, silt, sopp) eller uorganiske (jernoksider, jernsulfider, kalsium eller magnesiumkarbonater, sulfater, fosfater eller silikater).
Sulfáminsyre er veldig effektiv når det brukes til å eliminere kalsiumkarbonatinnlegg. Det kan brukes i kobberutstyr, messing, rustfritt stål, støpejern og galvanisert stål.
Det brukes i 5-10% løsning etter vekt. Det brukes spesielt i sukkerfabrikker for å rengjøre fordamper laget av støpejern med kobbervarmevekslere.
 Fordamperlag i en sukkerfabrikk. Forfatter: Antiksh Kumar. Kilde: Pixabay
Fordamperlag i en sukkerfabrikk. Forfatter: Antiksh Kumar. Kilde: Pixabay Det skal brukes ved temperaturer som ikke er større enn 50-60 ºC. 70 ºC temperaturer fører til dannelse av uoppløselige sulfater som tilfellet4.
Når det brukes kombinert med natriumklorid, oppstår en synergieffekt og løsningen lar jernoksid sakte oppløse. I dette tilfellet skal det ikke brukes med rustfritt stål fordi saltsyre frigjøres, noe som kan forårsake korrosjon i det materialet.
I metall raffinering
Metallelektrodeponering som kobber, sølv, kobolt, nikkel, sink, kadmium, jern og bly kan utføres med suksess i sulfaminsyreoppløsninger. Dette kan håndteres mye enklere enn hydroferbar syresyre (h2Sif6).
Som et mønsterreagens i laboratoriet
Gitt visse egenskaper ved sulfaminsyre som: dens kraft som syre, dens enkel å bli renset ved omkrystallisering i vann, dens stabilitet og dens ikke-hydroskopisitet, har den blitt brukt som en primær standard på laboratorietivå. Dette betyr at det brukes til kvantitative alkaliske bestemmelser.
 Laboratorium. Publicdomainpictures. Kilde: Pixabay
Laboratorium. Publicdomainpictures. Kilde: Pixabay I nitritesanalyse
På grunn av den enkle reaksjonen med nitritter, brukes sulfáminsyre for bestemmelse av disse i løsning.
Kan tjene deg: trikloreddiksyre: struktur, egenskaper, syntese, bruksområder, effekterI vannanalysen oppløst i vann
Siden den reagerende sulfaminsyre med vannnitritter frigjøres nitrogen, er det mulig å bestemme oksygen oppløst i vann, ettersom forstyrrelsen forårsaket av nitritter elimineres.
I lystgass
Sulfáminsyre reagerer med salpetersyre som genererer lystgass (n2ENTEN). Denne reaksjonen er tryggere enn ammoniumnitrat for å oppnå nevnte gass.
I landbruket
Et sulfáminsyrederivat, ammoniumsulfamat, er et ikke -toksisk ugressmiddel for dyr.
Det brukes av dugg på artene til arten som skal elimineres på slutten av sommeren eller begynnelsen av høsten, helst i fuktig vær. Når du flytter forbindelsen fra bladene til røttene, dør planten.
 Rocío herbicid -anvendelse. Forfatter: Zefe Wu. Kilde: Pixabay
Rocío herbicid -anvendelse. Forfatter: Zefe Wu. Kilde: Pixabay En annen fordel med denne forbindelsen er at bakken ikke steriliserer permanent. Noe ammoniumsulfamatnitrogen vil faktisk være tilgjengelig på bakken for plantevekst i neste sesong.
I brannsikre stoffer
Dens kompatibilitet med cellulose og dens brannhemmende karakteristikk konverterer ammoniumsulfamat til et middel for å oppnå brann -resistente stoffer og papir.
10% av vekten av stoffet brukes, hvis utseende og berøringsfølelse forblir uendret. Stoffet når det er i bruk skal vaskes tørt, aldri vasket med vann for ikke å løse opp til sulfamatet.
Det er nyttig spesielt på teatre eller lignende steder.
 Teater. Forfatter: Mustangjoe Kilde: Pixabay
Teater. Forfatter: Mustangjoe Kilde: Pixabay I forskjellige applikasjoner
Det brukes som en katalysator i noen kjemiske reaksjoner, som ved fremstilling av urea-formaldeharpikser. Det er også nyttig som bakteriemidler og stabilisator av klor i svømmebassenger og som en tremasse blekemiddel i masse- og papirfabrikker.
Referanser
- ELLER.S. National Library of Medicine. (2019). Sulfaminsyre. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov
- Williams, d.L.H. (2004) Nitrosering ved nitrogensentre. I nitroseringsreaksjoner og kjemien til nitrogenoksid. Kapittel 2. Gjenopprettet fra Scientedirect.com
- Clapp, Leallyn B. (1943). Sulfaminsyre og dens bruk. Chem. Utdanning. 1943, 20, 4, 189. Gjenopprettet fra puber.ACS.org
- McDonald, James. (2003). Sulfaminsyre. Gjenopprettet fra VeoliawateTech.com
- Sastri, v.S. (2010). Håndtering og kontroll av korrosjon. I Shreirs korrosjon. Gjenopprettet fra Scientedirect.com
- Bajpai Pratima. (2018). Diverse emner. I Biermanns håndbok for masse og papir. Tredje utgave. Gjenopprettet fra Scientedirect.com

