Svovelsyre
- 2765
- 419
- Marius Aasen
 Svovelsyre er en mineralsyre som oppstår når svoveldioksid løses opp i vann
Svovelsyre er en mineralsyre som oppstår når svoveldioksid løses opp i vann Hva er svovelsyre?
Han Svovelsyre Det er en oksácido som dannes når svoveldioksid, så2, oppløses i vann. Det er en svak og ustabil uorgansyre, som ikke kan påvises i oppløsningen, siden reaksjonen av den2 og h₂o).
Det er en fargeløs væsk.
Svovelsyremolekylet for øyeblikket er bare blitt påvist i gassfasen. De konjugerte basene til denne syren er vanlige anioner under form av sulfitter og bisulfitt.
Ramans spekter av SO -løsninger2 Det viser bare tegn på grunn av SO -molekylet2 og bisulfittion, HSO3-, I samsvar med følgende balanse:
SW2 + H₂o HSO3- + H+
Dette indikerer at det ved Ramans spekter ikke er mulig.
Når den blir utsatt for atmosfæren, blir den raskt transformert til svovelsyre. Svovelsyre reduseres til hydrogensulfid på grunn av virkningen av fortynnet svovelsyre og sink.
Forsøket på å konsentrere en så løsning2 Ved fordamping av vann for å oppnå vannfri svovelsyre, ga det ikke et resultat, siden syren dekomponerer raskt (investerer formasjonsreaksjonen), slik at syren ikke kan isoleres.
Struktur av Svovelsyre
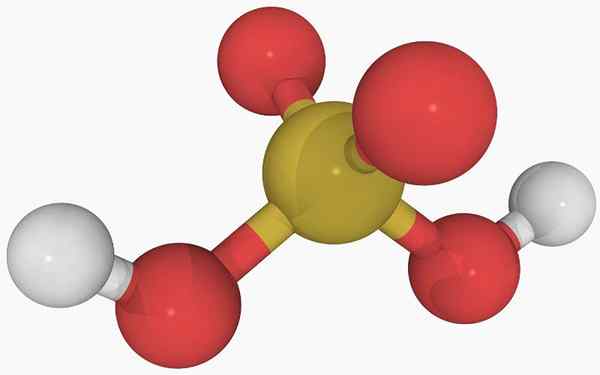
 Kjemisk struktur av svovelsyre
Kjemisk struktur av svovelsyre I hovedbildet kan strukturen til et isolert molekyl av svovelsyre i en gassformig tilstand sees. Den gule sfæren i sentrum tilsvarer svovelatomet, de røde til oksygenatomer og hvite til hydrogener.
Kan tjene deg: DiasteromersDens molekylære geometri rundt S -atomet er trigonal pyramide, med atomene til eller tegner basen.
Deretter, i gassformig tilstand, H -molekylene2SW3 De kan betraktes som mikroskopiske trigonale pyramider som flyter i luften, forutsatt at de er stabile nok til å vare litt tid uten å reagere.
Strukturen gjør det klart hvor de to sure hydrogenene kommer fra: fra hydroksylgruppene knyttet til svovel, ho-oh-oh. Derfor, for denne forbindelsen, er det ikke riktig å anta at en av syren protoner, h+, frigjøres fra svovelatomet, h-so2(ÅH).
De to OH -gruppene lar svovelsyre samhandle ved bruk av hydrogenbroer, og også oksygenet til bindingen S = O er en hydrogenakseptor, som gjør h2SW3 både i en god giver og akseptor av disse broene.
I følge det ovennevnte h2SW3 Jeg burde være i stand til å kondensere i en væske, som svovelsyre gjør, h2SW4. Likevel er det ikke slik det skjer.
Fysiske og kjemiske egenskaper til Svovelsyre
Molekylær formel
H2SW3
Molekylær vekt
82.073 g/mol.
Fysisk utseende
Det er en fargeløs væske, med en krydret svovelukt.
Tetthet
1.03 g/ml.
Damptetthet
2.3 (i forhold til luften tatt som 1)
Korrosivitet
Det er etsende for metaller og vev.
Vannløselighet
Blandbare.
Følsomhet
Det er luftfølsomt.
Stabilitet
Stabil, men uforenlig med sterke baser.
Surhetskonstant (ka)
1.54 x 10-2
Pka
1.81
Ph
1.5 på ph -skalaen.
tenningspunkt
Ikke brannfarlig.
Nedbrytning
Når den oppvarmes, kan svovelsyre brytes ned, og avgir en giftig røyk av svoveloksyd.
Kan tjene deg: kromhydroksid: struktur, egenskaper, syntese, brukNomenklatur
Svovel har følgende valenser: ± 2, +4 og +6. Fra formel h2SW3, Det kan beregnes hvilket valens- eller oksidasjonsnummer som har svovel i forbindelsen. For å gjøre dette er det nok å løse en algebraisk sum:
2 (+1) + 1V + 3 (-2) = 0
Siden det er en nøytral forbindelse, må summen av belastningene på atomene som utgjør den være 0. Rydding V For forrige ligning har du:
V = (6-2)/1
Dermed er v lik +4. Det vil si at svovel deltar med sitt andre Valencia, og i henhold til den tradisjonelle nomenklaturen må suffikset legges til navnet -ooso. Av denne grunn til H2SW3 Det er kjent som svovelsyreBjørn.
En annen raskere måte å bestemme denne Valencia, sammenligner H2SW3 med h2SW4.
I h2SW4 Svovel har Valencia +6, så hvis en eller, Valencia går ned til +4, og hvis en annen blir fjernet, går Valencia ned til +2 (noe som vil være tilfelle for syre hikkeSvovelBjørn, H2SW2).
Selv om det er mindre kjent, til H2SW3 Det kan også kalles trioxosulfuric acid (IV), ifølge bestandsnomenklatur.
Svovelsyredannelse i naturen
Svovelsyre dannes i naturen på grunn av kombinasjonen av svoveldioksid, produkt av aktiviteten til store fabrikker, med atmosfærisk vann.
Av denne grunn regnes det som et mellomprodukt av surt regn, noe som forårsaker stor skade på landbruket og miljøet.
Syntese
Teknisk sett dannes svovel for å danne svoveldioksid. Deretter løses den opp i vann for å danne svovelsyre. Reaksjonen er imidlertid reversibel og syren bryter raskt tilbake i reaktantene.
Dette er en forklaring på hvorfor svovelsyre ikke finnes i vandig løsning (som allerede nevnt i delen av dens kjemiske struktur).
Kan tjene deg: Beer-Lambe Lawapplikasjoner
Generelt sett, bruk og anvendelser av svovelsyre, siden dens tilstedeværelse ikke kan oppdages, referer til bruksområder og anvendelser av svoveldioksider og grunnlag og salter av syre.
I tre
I sulfittprosessen oppstår tremasse i form av nesten rene cellulosefibre. Flere salter av svovelsyre brukes til ekstraksjon av lignin fra tresplinter, ved bruk av høytrykksbeholdere kalt fordøyere.
Desinfeksjonsmiddel
Svovelsyre brukes som desinfeksjonsmiddel.
Blekemiddel
Det brukes også som en myk bleking, spesielt for klorfølsomme materialer. I tillegg brukes det som en tannblekemiddel og tilsetningsstoff.
Kosmetikk
Det er en ingrediens i forskjellige kosmetikk for hudpleie og ble brukt som et plantevernmiddelelement i eliminering av rotter. Eliminerer flekker forårsaket av vin eller frukt på forskjellige stoffer.
Antiseptisk middel
Det fungerer som antiseptisk, og er effektivt for å unngå hudinfeksjoner. I noen øyeblikk ble det brukt i fumigasjoner for å desinfisere skip, eiendeler til ofre for epidemier, etc.
Konserveringsmiddel
Svovelsyre brukes som konserveringsmiddel for frukt og grønnsaker og for å unngå gjæring av drinker som vin og øl, som en antioksidant, antibakteriell og soppdrepende element.
Kjemiske produkter
Svovelsyre brukes i syntesen av medisiner og kjemikalier, i utdyping av vin og øl, i foredling av oljeavledede produkter, og som et analytisk reagens.
Referanser
- Nomenklatur av syrer. Gjenopprettet fra 2.Kjemi.Gatech.Edu
- Calvo Flores, f. G. Uorganisk kjemiformulering. Ugr kommet seg.er

