Natriumkloritt (NaClO2) struktur, egenskaper, bruksområder, risikoer

- 3103
- 132
- Dr. Andreas Hopland
Han natriumkloritt Det er et uorganisk fast stoff dannet av et ion -natrium Na+ og en ionkloritt clo2-. Den kjemiske formelen er naclo2. Det er et krystallinsk hvitt fast stoff, i tillegg til å være et sterkt oksidasjonsmiddel. Derfor må det være veldig forsiktig.
Hovedbruken er som et desinfeksjonsmiddel for mange applikasjoner. Det gjør det mulig å eliminere mikrober på overflater som gulv, vegger og laboratorieutstyr på sykehus og klinikker og i deres vannsystemer.
 Natriumkloritt naClo2 fast. Forfatter: ChemicalInterest . Kilde: Wikimedia Commons.
Natriumkloritt naClo2 fast. Forfatter: ChemicalInterest . Kilde: Wikimedia Commons. Også i landbruks- og veterinæranlegg, for å hygienisere fugleegginkubatorer, for å kontrollere infeksjoner av melkekyr, for å desinfisere vannsystemer for dyr osv.
I matindustrien tjener de surde vandige oppløsninger til å vaske kjøtt, kyllinger, frukt, grønnsaker, samt utstyret til slike fasiliteter.
Med natriumkloritt kan klordioksid fremstilles2 På bruksstedet, som lar deg eliminere mikrober, dårlig lukt og smaker av vann, slik at det er behagelig og kan drikke uten problemer.
Det tjener også til å bleke papirmasse, vegetabilske tekstilfibre og oljer, blant andre applikasjoner.
NACLO2 Solid må håndteres med forsiktighet, fordi i kontakt med visse materialeksplosjoner kan oppstå. Løsningene deres er litt lettere å manipulere, men de er veldig oksiderende og etsende.
[TOC]
Struktur
Natriumkloritt består av et natriumna -kation+ og en anionkloritt clo2- Derfor er de forent av et ionisk bånd.
Klorittanionen har et kloratom i en +3 oksidasjonstilstand og to oksygenatomer med Valencia -2 hver. Av denne grunn har klorittanionen en negativ belastning.
Den har også en vinkelformet struktur.
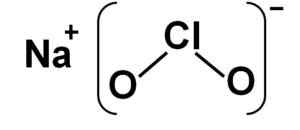 NaClo natriumklorittstruktur2. Forfatter: Marilú Stea.
NaClo natriumklorittstruktur2. Forfatter: Marilú Stea. Nomenklatur
- Natriumkloritt
- Natriumkloritt
- Natriumsalt av klor
Egenskaper
Fysisk tilstand
Krystallinsk hvitt fast stoff.
Molekylær vekt
90,44 g/mol.
Smeltepunkt
Den dekomponerer når den smelter mellom 180 og 200 ºC.
Tetthet
2.468 g/cm3
Løselighet
Vannløselig: 64 g/100 g vann ved 17 ºC. Litt løselig i metanol.
Andre egenskaper
Det er litt hygroskopisk.
Det er et sterkt oksidasjonsmiddel. Reagerer voldsomt med brennbare materialer og reduksjonsmidler. Reagerer voldsomt med syrer, genererer klordioksid clo2.
Kan tjene deg: Hume-Rothery RulesDets alkaliske løsninger (det betyr i nærvær av for eksempel NaOH) er ganske stabile, mens i surt medium dannes klorsyren Hclo2, som nedbryter raskt:
4 Hclo2 → 2 CLO2↑ + CLO3- + Cl- + 2 h+ + H2ENTEN
Risiko
Begge NaClo2 Solid ettersom de vandige oppløsningene deres er potensielt farlige og krever mye forsiktighet og erfaring under manipulering og lagring.
NACLO2 Fast kan eksplodere når du kommer i kontakt med organiske stoffer, inkludert hansker og klær, søl -kontrollmaterialer som sagflis og avfallsbomull, samt oljer og fett.
Den faste formen er derfor veldig vanskelig å transportere, og den foretrekkes å bruke den i form av vandige oppløsninger.
Disse løsningene er ekstremt etsende. De bør helst holde en pH over 8, det vil si en alkalisk pH.
NACLO2 akselererer forbrenningen av forbindelser eller brennbare materialer, til det punktet at det kan danne eksplosive blandinger med disse.
Hvis du er varm2ENTEN. Hvis den er forlenget til å varme eller brann, kan den utnytte.
Å skaffe
Det tilberedes å begynne med den kjemiske eller elektrokjemiske reduksjonen av brus NACLO3, I nærvær av HCl saltsyre for å produsere klordioksid CLO2.
Sistnevnte reagerer med hydrogenperoksyd H2ENTEN2 I NaOH natriumhydroksyd vandig oppløsning og en natriumnatriumklorittoppløsning oppnås2, som fordamper og krystalliserer det faste stoffet.
Det kan også oppnås ved å passere klordioksidgass2 For en NaOH -løsning.
2 Clo2 + 2 NaOH → NaClo2 + NaClo3 + H2ENTEN
applikasjoner
Som mikrobicid og desinfeksjonsmiddel i flere applikasjoner
Det er en ingrediens i mange produkter som tjener til å kontrollere bakterier, sopp og slam eller algesilt. Produkter som inneholder det for dette formålet brukes i landbruk, handel, industri og boliger eller hjem.
Det fungerer som et desinfeksjonsmiddel av mange typer materialer og overflater.
I landbruk er fjærkre og lignende næringer desinfiserte harde overflater, utstyr, fasiliteter for inkubering av fugleegg, drivhus for sopp som sopp, og kjølevann og vannvannsystemer for fuglerpenner.
Den har veterinærbruk som et aktuelt desinfeksjonsmiddel i kontrollen av mastitt av melkefe, for å fordype dyrets brystvorter. Mastitt er en infeksjon av kyr.
Kan tjene deg: Adiabatisk prosess: Typer, eksempler, løste øvelser Noen ganger må du fordype kyr i natriumklorittløsninger for å unngå infeksjoner i dem. Forfatter: Hans Braxmeier. Kilde: Pixabay.
Noen ganger må du fordype kyr i natriumklorittløsninger for å unngå infeksjoner i dem. Forfatter: Hans Braxmeier. Kilde: Pixabay. Det brukes også i naturlige forskningsinstitusjoner for å dekontaminere laboratorier.
Kommersiell, industriell og medisinsk bruk inkluderer desinfiserende ventilasjonssystemer, harde overflater (for eksempel gulv, vegger, laboratorieutstyr) og vannsystemer.
I helsetjenester som klinikker og sykehus brukes det til å dekontaminere rom, korridorer, isolasjonsområder og materialsterilisering.
Det er også nyttig for hygienisering i bedrifter der folk gjennomgår vann- eller spa -helsebehandlinger.
I matindustrien brukes det som en fumigant for å spare mat.
Det brukes i form av surgjort natriumkloritt. Dette produseres ved å tilsette matgradsyre (for eksempel sitronsyre, fosforsyre, hjulesyre eller natriumsyresulfat) til en vandig løsning av natriumkloritt.
Surert natriumkloritt har antimikrobielle egenskaper og brukes som en dugg eller kyllingvask- eller soaking -løsning, kjøtt, grønnsaker, frukt og sjøprodukter. Også i vann for å fryse kylling eller fugler.
I husholdninger tillater det å desinfisere harde overflater, for eksempel gulv og bad, oppvarming eller klimaanlegg og bassengvannssirkulasjonssystemer.
 For å desinfisere bassenger kan du bruke natriumklorittnaclo2. Forfatter: Age Global Group. Kilde: Pixabay.
For å desinfisere bassenger kan du bruke natriumklorittnaclo2. Forfatter: Age Global Group. Kilde: Pixabay.  Produkter som inneholder natriumkloritt, tillater toalettbad. Forfatter: Michal Jarmoluk. Kilde: Pixabay.
Produkter som inneholder natriumkloritt, tillater toalettbad. Forfatter: Michal Jarmoluk. Kilde: Pixabay. Det selges også i små poser sammen med andre forbindelser for å frigjøre gass- og kontrolllukt i hjemmet.
Å desinfisere drikkevann
Det brukes i rensing av vann til å drikke, fungerer som en oksidant, og forbedrer smaken og lukten av drikkevann.
Natriumkloritt er mye brukt som en forløper for generering av CLO -klordioksid2 som tjener til å behandle drikkevann til konsum, det vil si å eliminere mikroorganismer, lukt og ubehagelige smaker og kan drikke.
Å generere CLO2 HCl kan brukes:
5 NaClo2 + 4 HCl → 4 CLO2↑ + 5 NaCl + 2 H2ENTEN
CLO2 Det er et antimikrobielt middel for oksidant og bredt spektrum med høyt handling. Det vil si handler mot et stort antall mikroorganismer.
Det kan tjene deg: Kaliumnitritt (KNO2): Struktur, egenskaper og brukMikroorganismer er deaktivert fordi CLO2 forstyrrer viktige enzymer av disse og med cellemembraner proteiner. Det har også fordelen at den ikke produserer organoklorforbindelser, som er giftige.
Det er til salgs natriumkloritttabletter blandet med andre forbindelser som er oppløst i vannet og produserer umiddelbart CLO2 på en kontrollert måte, og desinfiserer dermed vannet.
 Natriumkloritt brukes med andre forbindelser for å oppnå drikkevann som er klart til å drikke. Forfatter: Ulrike Leone. Kilde: Pixabay.
Natriumkloritt brukes med andre forbindelser for å oppnå drikkevann som er klart til å drikke. Forfatter: Ulrike Leone. Kilde: Pixabay. Hovedproblemet med å behandle vann for å fjerne smaker og lukter gjennom CLO2 Det består i at giftig kloritt og klorsalter kan dannes under behandlingen.
For kontaktlinsepleie
NACLO2 Det er en komponent av løsningene som brukes til å desinfisere kontaktlinser.
En NaClo -kombinasjon brukes2 og spor (veldig små mengder) hydrogenperoksyd H2ENTEN2.
H2ENTEN2 Stabiliserer CLO2 som dannes og kombinasjonen av begge er veldig effektivt mot bakterier, sopp og gjær. Produktene som er da er natriumklorid, vann og oksygen, som er ufarlige, noe som betyr at de ikke er skadelige for øyet.
Når linsene fjernes fra løsningen, er NaClo2 Rest dekomponerer raskt i nall og o2. Restperoksyd irriterer ikke øyet. Derfor er disse løsningene veldig trygge.
 Løsningene på desinfeksjon av kontaktlinser har natriumkloritt blant ingrediensene. Forfatter: Nieuw ~ Commonswiki. Kilde: Wikimedia Commons.
Løsningene på desinfeksjon av kontaktlinser har natriumkloritt blant ingrediensene. Forfatter: Nieuw ~ Commonswiki. Kilde: Wikimedia Commons. I forskjellige applikasjoner
Natriumkloritt brukes til klordioksidforberedelse2 for øyeblikkelig bruk i et stort antall applikasjoner som noen ble behandlet i tidligere avsnitt.
Det tjener til å bleke tremasse, tekstiler som bomull, plantefibre, spiselige og ikke -spiselige oljer, fett, lakk, lakk og voks.
Det er en komponent av øyedråper og noen løsninger for oral vasking.
Det brukes i lærbehandlingsindustrien og i midler for metallelektrode (metallbelegg).
Referanser
- Williams, l. et al. (2019). Mikrobiologi, objektivpleie og vedlikehold. I kontaktlinser (sjette utgave). Gjenopprettet fra Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Natriumkloritt. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Gray, n.F. (2014). Klordioksid. Prosessteknologi. I mikrobiologi av vannbårne sykdommer (andre utgave). Gjenopprettet fra Scientedirect.com.
- McKen, l. (2012). Introduksjon til matradisjon og medisinsk sterilisering. Klordioksid. I effekten av sterilisering på plast og elastomerer (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Ortenberg, e. og Telsch, B. (2003). Smak og luktproblemer i drikkevann. I Handbook of Water and Wastewater Microbiology. Gjenopprettet fra Scientedirect.com.
- Karsa, d.R. (2007). Biocider. Klordioksid. I håndbok for rengjøring/dekontaminering av overflater. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. VCH Verlagsgellschaft MBH.

