Kobberklorid (I) (CUCL) struktur, egenskaper, bruk
- 2333
- 449
- Thomas Karlsen
Han Kobberklorid (i) Det er en uorganisk forbindelse dannet av kobber (Cu) og klor (CL). Den kjemiske formelen er cucl. Kobberen i denne forbindelsen har Valencia på +1 og klor -1. Det er et hvitt krystallinsk fast stoff som når den blir utsatt lenge i luften tilegner seg en grønnaktig farge på grunn av oksidasjon av kobber (i) til kobber (II).
Den oppfører seg som Lewis -syre som trenger elektroner av andre forbindelser som er Lewis -baser, som danner kompleks eller stabile addukter. En av disse forbindelsene er karbonmonoksid (CO), så evnen til å bli med mellom dem brukes industrielt for å trekke ut CO med brus.
 Kobberklorid (i) (CUCL) renset. Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Kobberklorid (i) (CUCL) renset. Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Den har optiske egenskaper som kan brukes i lysemitterende halvledere. I tillegg har CUCL -nanokubene stort potensiale for å brukes i effektive energienheter.
Det brukes i kunsten å pyrotekniske fordi i kontakt med en flamme produserer et blåaktig grønt lys.
[TOC]
Struktur
CUCL er dannet av Cuproso Cupion+ og anionklorid CL-. Den elektroniske konfigurasjonen av ion Cu+ er:
1s2 2s2 2 s6 3s2 3p6 3d10 4s0
Og det er fordi kobber mistet elektronet i 4S -laget. Kloridionet har konfigurasjonen:
1s2 2s2 2 s6 3s2 3p6
Det kan sees at begge ionene har sine komplette elektroniske lag.
Denne forbindelsen krystalliserer med kubisk symmetri. På bildet nedenfor observeres arrangementet av atomene i en krystallinsk enhet. Rosa kuler tilsvarer kobber- og grønne kuler til klor.
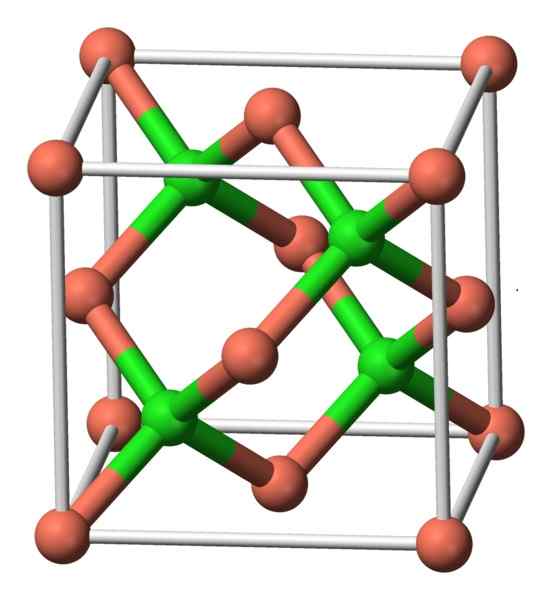 CUCL -struktur. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
CUCL -struktur. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Nomenklatur
- Kobberklorid (i)
- Cuprous klorid
- Kobbermonoklorid
Egenskaper
Fysisk tilstand
Krystallinsk hvitt fast stoff som i langvarig luft med luft oksideres og blir grønn.
Molekylær vekt
98,99 g/mol
Smeltepunkt
430 ºC
Kokepunkt
Cirka 1400 ºC.
Tetthet
4.137 g/cm3
Løselighet
Nesten uoppløselig i vann: 0,0047 g/100 g vann ved 20 ° C. Uoppløselig i etanol (C2H5Å) og aceton (velg3(C = O) CH3).
Det kan tjene deg: Alilo: Allyic Unit, Carbocation, Radical, EksemplerKjemiske egenskaper
Det er ustabilt i luften fordi Cu+ har en tendens til å oksidere Cu2+. Over tid blir Cupric Oxide (CUO), Cuprous Hydroxide (CUOH) eller et komplekst oksyklorid og salt blitt grønt.
 Kobberklorid (i) som har blitt utsatt for miljøet og delvis oksidert. Cuoh, cuoh og andre forbindelser kan inneholde. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
Kobberklorid (i) som har blitt utsatt for miljøet og delvis oksidert. Cuoh, cuoh og andre forbindelser kan inneholde. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. I vandig løsning er det også ustabil fordi en oksidasjons- og reduksjonsreaksjon oppstår samtidig, og danner metallisk kobber- og kobberion (II):
CUCL → Cu0 + Cucl2
Cucl som Lewis -syre
Denne forbindelsen fungerer kjemisk som Lewis -syre, noe som betyr at den er ivrig etter elektroner, så den danner stabile addukter med forbindelser som kan gi dem.
Det er veldig løselig i saltsyre (HCl), hvor CL -ioner- De oppfører seg som elektrondonorer og arter som Cucl er dannet2-, Cucl32- og Cu2Cl42-, blant andre.
 Dette er en av artene som er dannet i CUCL -løsningene i HCL. Forfatter: Marilú Stea.
Dette er en av artene som er dannet i CUCL -løsningene i HCL. Forfatter: Marilú Stea. Vandige CUCL -løsninger har evnen til å absorbere karbonmonoksid (CO). Denne absorpsjonen kan oppstå når disse løsningene er både sure og nøytrale eller med ammoniakk (NH3).
I slike løsninger anslås det at forskjellige arter som Cu (CO) dannes+, Gjøk)3+, Gjøk)4+, Cucl (CO) og [Cu (CO) Cl2]-, som avhenger av mediet.
Andre egenskaper
Den har elektrooptiske egenskaper, lavt optisk tap i et bredt spekter av lysspekteret fra synlig til infrarødt, lav brytningsindeks og konstant dielektrisk lav.
Å skaffe
Kobberklorid (I) kan oppnås ved å reagere metallkobberen direkte med klorgass ved en temperatur på 450-900 ° C. Denne reaksjonen gjelder industrielt.
2 Cu + Cl2 → 2 Cucl
Du kan også bruke en reduserende forbindelse som askorbinsyre eller svoveldioksid for å føre kobberklorid (II) til kobberklorid (i). For eksempel i tilfelle av SO2, Dette oksideres til svovelsyre.
2 Cucl2 + SW2 + 2 h2O → 2 CUCL + H2SW4 + 2 HCl
applikasjoner
I co -gjenopprettingsprosesser
Evnen til absorberende og insorberende løsninger.
Kan tjene deg: turbidimetriFor eksempel bruker prosessen som kalles Cosorb stabilisert kobberklorid i form av et komplekst salt med aluminium (AnyCl4), som oppløses i et aromatisk løsningsmiddel som toluen.
Løsningen absorberer CO for en gassinnstrøm for å skille den fra andre gasser som CO2, N2 og Ch4. Deretter blir løsningen rik på monoksidet oppvarmet under redusert trykk (det vil si lavere enn atmosfæren) og CO er Exorg. Gassen som er utvunnet på denne måten er høy renhet.
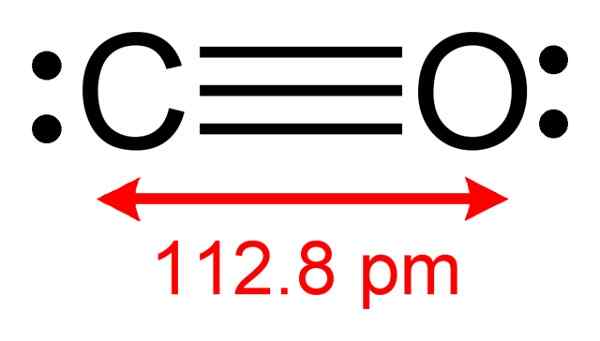 Karbonmonoksidstruktur der elektroner som er tilgjengelige for å danne kompleks med CUCL, observeres. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Karbonmonoksidstruktur der elektroner som er tilgjengelige for å danne kompleks med CUCL, observeres. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Denne prosessen lar deg få en ren CO.
På katalyse
CUCL brukes som katalysator for forskjellige kjemiske reaksjoner.
For eksempel reaksjonen fra Germanio (GE) -elementet med hydrogenklorid (HCl) og etylen (CH2= Ch2) kan gjøres ved hjelp av denne forbindelsen. Det tjener også for syntese av organiske silisiumforbindelser og varierende heterocykliske organiske derivater av svovel og nitrogen.
Du kan syntetisere en polyfenileneter-polymer ved bruk av et 4-amypirin og hukkatalytisk system. Denne polymeren er veldig nyttig for sine mekaniske egenskaper, lite fuktabsorpsjon, utmerket isolasjon av elektrisitet og brannmotstand.
Ved å få organiske kobberforbindelser
Alkenilcupratato -forbindelser kan fremstilles ved å reagere en terminal alky.
Ved å skaffe polymerer forenet til metaller
Kobberklorid (I) kan koordineres med polymerer som danner komplekse molekyler som fungerer som katalysatorer og som kombinerer enkelheten til en heterogen katalysator med regelmessigheten av en homogen.
I halvledere
Denne forbindelsen brukes til å oppnå et materiale dannet av y-Corpu på silisium.
Disse materialene har bred bruk i ultrafiolett lysutslippsdioder, laserdioder og lysdetektorer.
Kan tjene deg: kaliumbromid (KBR): Struktur, egenskaper, brukI Super Cardpisors
Dette produktet oppnådd i form av kubikk eller nanokubes nanopartikler gjør det mulig.
Supercorders er enheter for lagring av energi som skiller seg ut for deres høye krafttetthet, drift i operasjonen, hurtig belastnings- og utladningssykluser, langvarig stabilitet og er miljøvennlige.
 Nanocubos Cucl kan brukes i elektronikk og energilagringsapplikasjoner. Forfatter: tidevann han. Kilde: Pixabay.
Nanocubos Cucl kan brukes i elektronikk og energilagringsapplikasjoner. Forfatter: tidevann han. Kilde: Pixabay. Andre apper
Gi.
 Den grønne fargen på noe fyrverkeri kan skyldes snorken. Forfatter: Hans Braxmeier. Kilde: Pixabay.
Den grønne fargen på noe fyrverkeri kan skyldes snorken. Forfatter: Hans Braxmeier. Kilde: Pixabay. Referanser
- Milek, J.T. og Neuberger, m. (1972). Klorid Cuprous. I: Lineære elektrooptiske modulære materialer. Springer, Boston, MA. Lenke gjenopprettet.Springer.com.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Sneeden, r.P.TIL. (1982). Absorpsjon/desorpsjonsmetoder. I omfattende organometallisk kjemi. Volum 8. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Chandrashekhar, v.C. et al. (2018). Nyere fremskritt i direkte syntese av organometalliske og koordinasjonsforbindelser. I direkte syntese av metallkomplekser. Gjenopprettet fra Scientedirect.com.
- Kyushin, s. (2016). Organosilicon syntese for konstruksjon av organosilicon -klynger. I effektive metoder for preparat silisiumforbindelser. Gjenopprettet fra Scientedirect.com.
- Van Koten, G. og Noltes, J.G. (1982). Organokoppforbindelser. I omfattende organometallisk kjemi. Volum 2. Gjenopprettet fra Scientedirect.com.
- Danieluk, d. et al. (2009). Optiske egenskaper til udopede og oksygen dopede cucl -filmer på silisium sublate. J Mater Sci: Mater Electron (2009) 20: 76-80. Lenke gjenopprettet.Springer.com.
- Yin, f. et al. (2014). Cuprous klorid nanocubes dyrket på kobber mislykkes for pseudokapacitorelektroder. Nano-Micro Lett. 6, 340-346 (2014). Lenke gjenopprettet.Springer.com.
- Kim, k. et al. (2018). En svært effektiv aromatisk aminligand/kobber (i) klorid. Polymers 2018, 10, 350. MDPI kom seg.com.
- Wikipedia (2020). Kobber (i) klorid. Innhentet fra.Wikipedia.org.
- « Molar fraksjon hvordan det beregnes, eksempler, øvelser
- Butyric fat oppnådd, typer, sammensetning, bruksområder »

