Tinnklorid (ii)
- 3972
- 949
- Prof. Oskar Aas
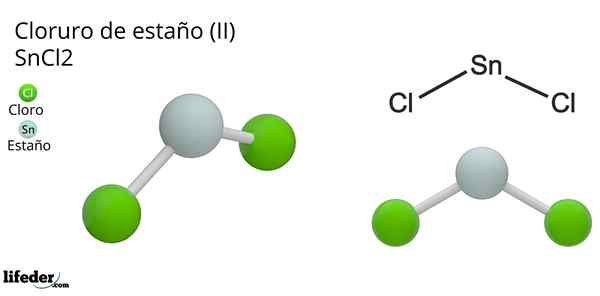
Han Tinnklorid (Ii) eller bittesmå klorid, av den kjemiske formelen SNCL2, Det er en hvit og krystallinsk fast forbindelse, produkt av tinnreaksjonen og en konsentrert saltsyreoppløsning: SN (S) + 2HCl (Conc) => SNC2(aq) + h2(g). Prosessen med syntesen (preparatet) består i å tilsette tinnstykker for å reagere med syre.
Etter å ha tilsatt tinnbitene, utføres dehydrering og krystallisering til det uorganiske saltet er oppnådd. I denne forbindelsen har tinnet mistet to elektroner i valenslaget for å danne koblinger med kloratomer.
Dette kan forstås bedre hvis Tin Valencia -konfigurasjonen vurderes (5s25 sx2pog0pz0), hvorav paret med elektroner som okkuperer orbital px er tildelt protonene h+, For å danne et diatomisk hydrogenmolekyl. Det vil si at dette er en reaksjon av redoks -typen.
[TOC]
Tinnkloridegenskaper
 Tinnklorid (ii) dihydrat
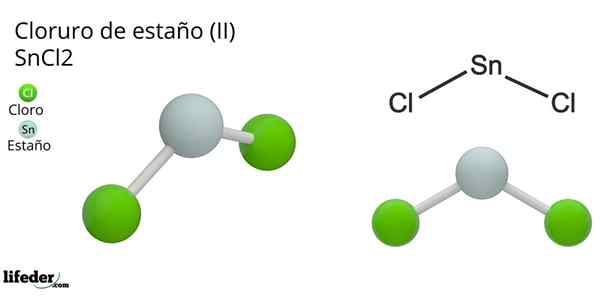
Tinnklorid (ii) dihydrat SNCL -lenker2 De er ioniske eller kovalente type? De fysiske egenskapene til tinnklorid (ii) kast det første alternativet. Fusjons- og kokepunktene for denne forbindelsen er 247 ºC og 623 ºC, noe som indikerer svake intermolekylære interaksjoner, vanlig faktum for kovalente forbindelser.
Krystallene hans er hvite, som oversettes til null absorpsjon i det synlige spekteret.
Valencia -konfigurasjon
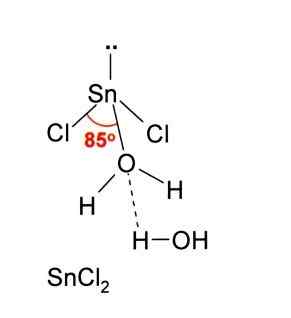
På bildet over illustreres en isolert mynte av Snick2.
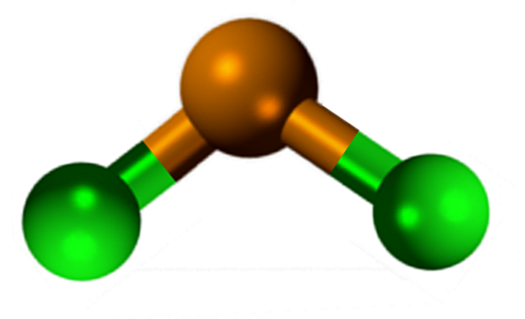
Molekylær geometri skal være flat fordi hybridiseringen av det sentrale atomet er SP2 (3 SP orbitals2 og en ren p -orbital for å danne kovalente bindinger), men det elektronfrie dreiemomentet opptar volumet og skyver kloratomene ned, og gir molekylet en vinkelgeometri.
I gassfase er denne forbindelsen isolert, så den ikke samhandler med de andre molekylene.
Kan tjene deg: ForlengelseSom tap av paret med elektroner i orbital px, Tinn transformerer seg til snionen2+ og dens resulterende elektroniske konfigurasjon er 5s25 sx0pog0pz0, Med alle orbitaler tilgjengelig for å akseptere lenker fra andre arter.
CL -ioner- De koordinerer med snionen2+ Å gi opphav til tinnklorid. Elektronisk tinnkonfigurasjon i dette saltet er 5s25 sx2pog2pz0, Å kunne godta et annet par elektroner i din gratis orbital Pz.
For eksempel kan du godta et annet ion CL-, danner det trigonale flate geometri -komplekset (en trekantet basepyramide) og negativt lastet [SNCL3]-.
Reaktivitet
SNCL2 Det har høy reaktivitet og trend å oppføre seg som Lewis -syre (elektronreseptor) for å fullføre sin Valencia -oktett.
I tillegg til å godta et ion CL-, Det samme gjelder vann, som "hydrerer" tinnatomet når et vannmolekyl er koblet direkte til tinnet, og et andre vannmolekyl danner interaksjoner med hydrogenbroer med den første.
Resultatet av dette er at SNCL2 Det er ikke rent, men koordinert med vannet i det dihydrerte saltet: SNCL2· 2H2ENTEN.
SNCL2 Det er veldig løselig i vann og polare løsningsmidler, fordi det er en polar forbindelse. Imidlertid aktiverer løseligheten i vann, mindre enn dens massevekt, en hydrolysereaksjon (brudd på et vannmolekyl) for å generere et basisk og uoppløselig salt:
Sncl2(aq) + h2Eller (l) Sn (OH) Cl (S) + HCl (AQ)
Den doble pilen indikerer at en balanse er etablert, foretrukket til venstre (mot reagensene) hvis HCL -konsentrasjonene øker. Derfor SNCL -løsninger2 Ansatte har en sur pH, for å unngå nedbør av uønsket saltprodukt av hydrolyse.
Det kan tjene deg: nukleofil: nukleofilt angrep, typer, eksempler, nukleofilisitetReduktiv aktivitet
Reagerer med oksygenet i luften for å danne tinnklorid (IV) eller klorid er:
6 Sncl2(aq) + o2(g) + 2H2Eller (l) => 2SNCL4(AQ) + 4SN (OH) CL (S)
I denne reaksjonen oksiderer tinnet dannende kobling med det elektronegative oksygenatom og øker antall bindinger med kloratomer.
Generelt stabiliserer de elektronegative atomer av halogener (F, CL, BR og I) koblingene til Sn (IV) forbindelser, og dette faktum forklarer hvorfor SNCL2 er et reduserende middel.
Når det er oksidert og mister alle valenselektronene, SN -ionet4+ er 5S -konfigurasjon05 sx0pog0pz0, Å være et par elektroner i 5S orbital er det vanskeligste å bli "tatt bort".
Kjemisk struktur av tinnklorid
 Tinnkloridstruktur (ii)
Tinnkloridstruktur (ii) SNCL2 Den presenterer en krystallinsk struktur av ortorrombisk type, lik serruchos rader, der tipsene til tennene er klorider.
Hver rad er en SNCL -kjede3 danner en CL-bro med et annet SN-atom (CL-SN (CL)2-Cl- ···). To kjeder, sammen med svake interaksjoner av SN-Cl-typen utgjør et lag av arrangementet, som overlapper over et annet lag, og så videre til de definerer det krystallinske faste stoffet.
Gratis elektronpar 5s2 Forårsake forvrengning i strukturen fordi den opptar volum (volumet til den elektroniske skyen).
SN kan ha et koordineringsnummer som tilsvarer ni, noe som er det samme som å ha ni naboer, og tegner et trigonalt prisme med dette som ligger i sentrum av den geometriske figuren og CL i toppunktene, i tillegg til andre CL som ligger i hver av torget ansikter til prisme.
Kan tjene deg: hydraceDette er lettere å observere om det regnes som en kjede der SN (mørkegrå sfærer) peker opp, og de tre CL koblet med denne formen det trekantede gulvet, mens de tre klientene danner det øvre trekantede taket.
Bruk/applikasjoner
I organisk syntese brukes det som et reduksjonsmiddel for aromatiske nitroforbindelser (AR-nei2 à ar-nh2). Ettersom den kjemiske strukturen er laminær, finner den bruk i verden av organiske reaksjoner katalyse, i tillegg til å være en potensiell kandidat for katalytisk støtte.
Den reduserende egenskapen utnyttes for å bestemme tilstedeværelsen av gullforbindelser, for å dekke glass med sølvspeil og for å tjene som antioksidant.
I sin molekylære geometri trigonal pyramide (: SNX3- M+) brukes som en Lewis -base for syntese av et stort antall forbindelser (for eksempel PT -klyngekomplekset3Sn8Cltjue, der det elektronfrie paret er koordinert med en Lewis -syre).
Risiko
SNCL2 Du kan skade hvite blodlegemer. Det er etsende, irriterende, kreftfremkallende og har høye negative innvirkninger på arten som bor i marine økosystemer.
Kan dekomponere ved høye temperaturer, og frigjøre den skadelige klorgassen. I kontakt med veldig oksidasjonsmidler utløser eksplosive reaksjoner.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. I Elementene i gruppe 14 (Fjerde utgave., p. 329). Mc Graw Hill.
- ChemicalBook. (2017). ChemicalBook: ChemicalBook.com
- Pubchem. (2018). Tinnklorid. Pubchem Gjenvunnet: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2017). Tinn (ii) klorid. Wikipedia ble frisk: i.Wikipedia.org
- F. Hulliger. (1976). Strukturell kjemi av faser av lagstype. P-120,121. D. Reidel Publishing Company.

