Kvikksølvklorid (II) struktur, egenskaper, innhenting, bruk
- 4748
- 1203
- Anders Mathisen
Han Kvikksølvklorid (II) Det er en uorganisk forbindelse dannet av et atom i metallkvikksølvet (Hg) og to atomer i klorhalogenet (CL). Kvikksølv er i sin +2 oksidasjonstilstand og klor -1.
Den kjemiske formelen er HGCL2. Det er et litt flyktig krystallinsk fast stoff ved romtemperatur. Fagforeninger blant atomene deres er mer kovalente enn ioniske.
 Kvikksølvklorid (II). MRGreen71/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Kvikksølvklorid (II). MRGreen71/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Når den oppløses i vann, opprettholder den molekylstrukturen. Det er også løselig i flere organiske løsningsmidler. Med lys av lys har det en tendens til å danne metallisk kvikksølv.
Tidligere ble det brukt som et antiseptisk middel og for å behandle visse smittsomme sykdommer, både hos mennesker og dyr. Også som et insektmiddel for å kontrollere skadedyr som maur og termitter.
Når deres høye toksisitet er bekreftet, ble de fleste av disse bruksområdene imidlertid forlatt og brukes foreløpig bare i kjemi eller biokjemiske analyselaboratorier.
Kan utnytte under visse forhold. Det er en giftig forbindelse, det forårsaker skade på mennesker, dyr og planter. Det skal aldri kastes til miljøet. Det er også mistenkt for å være kreftfremkallende.
[TOC]
Struktur
Kvikksølvklorid består av Hg i oksidasjon II og klor med Valencia -1. I denne Haluro har koblingene mellom atomene en veldig markert kovalent karakter.
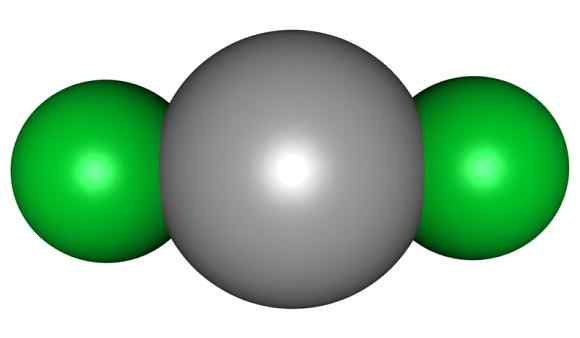 HGCL -molekyl2. Grå = kvikksølv; Grønn = klor. ArrowsMaster / Public Domain. Kilde: Wikimedia Commons.
HGCL -molekyl2. Grå = kvikksølv; Grønn = klor. ArrowsMaster / Public Domain. Kilde: Wikimedia Commons. Dette betyr at forbindelsen i glasset opprettholder sin molekylstruktur CL-Hg-CL der Hg-Cl-avstanden ligner når den er i gassform, mens avstanden i glasset med kloratomer i andre molekyler i glasset er mye eldre.
 HGCL -molekylerarrangement2 I glasset. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
HGCL -molekylerarrangement2 I glasset. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. I gassformig er det tydelig molekylær og også i vandig løsning.
Nomenklatur
- Kvikksølvklorid (II)
- Merkurisk klorid
- Kvikksølvbiklorid
- Dicloromercurio
Egenskaper
Fysisk tilstand
Hvitt krystallinsk faste, rombiske krystaller.
 Solid Mercuric -klorid. Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Solid Mercuric -klorid. Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Molekylær vekt
271,5 g/mol
Smeltepunkt
280 ºC
Sublimeringspunkt
Ved 300 ° C Sublima, det vil si at det går direkte fra gassfast.
Tetthet
5.6 g/cm3
Løselighet
Lite vannoppløselig: 7,31 g/100 ml ved 25 ° C. Alkoholoppløselig: 33 g/ 100 ml ved 25 ° C. Etylacetatoppløselig. Lite oppløselig i eter: 4 g/100 ml. Noe løselig i benzen.
Det kan tjene deg: Helmholtz gratis energi: enheter, hvordan den beregnes, løste øvelserPh
En løsning på 0,2 mol/l har en pH på 3,2-4,7.
Kjemiske egenskaper
I vandig løsning er det nesten utelukkende (∼ 99%) i form av et HGCL -molekyl2. Imidlertid lider det litt hydrolyse:
HGCL2 + H2Eller ⇔ Hg (OH) Cl + H+ + Cl-
HGCL2 + 2 h2Eller ⇔ Hg (OH)2 + 2 h+ + 2 Cl-,
Den presenterer en markert løselighet i organiske løsningsmidler, der den tar form av dimerer, det vil si to bundne molekyler.
I nærvær av organisk materiale og ved handling av sollys reduseres det å danne kvikksølvklorid (I) (HGCL) og deretter metallisk kvikksølv.
HGCL2 + Sollys → HGCL → HG0
Med natriumhydroksydoppløsning (NaOH) genererer et gult precurum gult bunnfall (HGO).
Det er inkompatibelt eller reagerer med former, sulfitter, fosfater, sulfider, gelatin, albumin, alkalier, ammoniakk, kalsiumhydroksyd, bromider, karbonater, jern, kobber, bly, sølvsalter og noen plantematerialer.
Andre egenskaper
På grunn av blant annet den mest kovalente enn ioniske karakteren, er den litt ustabil ved romtemperatur og den er betydelig flyktig ved 100 ° C.
Å skaffe
Du kan tilberede oksiderende metallisk kvikksølv (HG0) med klorgass (CL2). Når du oppvarmer og når mer enn 300 ° C, vises en flamme og en damp som samles, blir sublimert, og når HGCL -krystaller dannes2.
Hg + Cl2 + Varme → HGCL2
Det oppnås også ved oppvarming av kvikksølvsulfat (ii) tørt med natriumklorid. HGCL -damper2 at subliman blir samlet og kondensert til et krystallinsk fast stoff.
HGSO4 + 2 NaCl → HGCL2 + Na2SW4
Reaksjonen mellom kvikksølvoksid (II) med saltsyre i støkiometriske mengder produserer HGCL -krystaller2 Når mediet er avkjølt.
HGO + 2 HCL → HGCL2 + H2ENTEN
Krystaller kan renses ved omkrystallisering og sublimering.
applikasjoner
I kjemiske laboratorier
Det brukes som et reagens i forskjellige kjemiske analyser. Det tillater fremstilling av andre kvikksølvforbindelser, for eksempel kvikksølvjodid (II), kvikksølvoksid (II), kvikksølvklorid (I), ammonium og kvikksølvklorid (II).
Kan tjene deg: Fluor: Historie, egenskaper, struktur, innhenting, risiko, brukI patologilaboratorier
Det er en del av den eddiske løsningen av Zenker, som brukes til å behandle prøver eller eksempler på benmargsbiopsier. Vevene settes raskt med utmerkede histologiske detaljer som skal observeres med mikroskopet.
 Noen ganger HGCL2 Det brukes i patologilaboratorier. Forfatter: Ernesto Eslava. Kilde: Pixabay.
Noen ganger HGCL2 Det brukes i patologilaboratorier. Forfatter: Ernesto Eslava. Kilde: Pixabay. Forlatte bruksområder
I middelalderen og frem til begynnelsen av XX ble det brukt i forskjellige applikasjoner, ettersom dens skadelige effekt for helse var ukjent.
- Som behandling av visse sykdommer, aktuell antiseptisk og desinfeksjonsmiddel.
 Tidligere HGCL2 Den ble brukt til å behandle syfilis. G. H. Fox / Public Domain. Kilde: Wikimedia Commons.
Tidligere HGCL2 Den ble brukt til å behandle syfilis. G. H. Fox / Public Domain. Kilde: Wikimedia Commons. - I veterinærmedisin som kaustisk, desinfeksjonsmiddel og antiseptisk middel.
- I landbruket fungerte han som et soppdrepende middel, for å kontrollere landorm, som insektmiddel og avvisende av kakerlakker, maur og termitter, og som et desinfeksjonsmiddel for å beskytte frø og pærer.
- For trebevaring, kjemisk middel til å balansere og bevare anatomiske prøver.
- Som en katalysator for å oppnå vinylklorid fra acetylen.
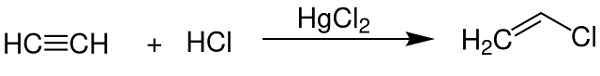 Kvikksølvklorid (II) fungerer som en katalysator for å oppnå noen kjemiske forbindelser. Chem Sim 2001 / Public Domain. Kilde: Wikimedia Commons.
Kvikksølvklorid (II) fungerer som en katalysator for å oppnå noen kjemiske forbindelser. Chem Sim 2001 / Public Domain. Kilde: Wikimedia Commons. - I aluminiumelektrode.
- Å merke jern og stål.
- Som fotograferingsreagens.
- I tekstilutskrift, som en mordant for kanin- og ricinpels, for trefargestoff.
- Som en komponent av tørkede batterier.
Risiko
Til helse
Det er en etsende og ekstremt giftig forbindelse hvis den er inntatt, da det kan forårsake døden. Angriper mage -tarmkanalen og nyresystemet. Forårsake alvorlige forbrenninger på huden og øynene.
Langvarig eller gjentatt eksponering for denne forbindelsen forårsaker skade på indre organer. Alle former for kvikksølv er giftige og HGCL2 er en av de mest giftige.
Det er mistenkt at det er kreftfremkallende.
Brannfare
Selv om det ikke er drivstoff kan eksplodere når du bruker varme. Når det bryter sammen giftige og kvikksølv giftige gasser.
HGCL -blandinger2 Med alkaliske metaller som natrium eller kalium er de veldig følsomme for slag og kan utnytte med virkningene. Hvis du kommer i kontakt med ammoniakk, kan sulfider, oksalsyre og acetylen også eksplodere.
Kan tjene deg: saltsyre (HCl)Effekter på miljøet
Det er veldig giftig for akvatiske og landorganismer, dens effekter varer over tid. Det kan presentere bioakkumulering i hele næringskjeden, både i planter og dyr.
 Merkurisk klorid skal aldri kastes i miljøet. Forfatter: Naadjuuh. Kilde: Wikimedia Commons.
Merkurisk klorid skal aldri kastes i miljøet. Forfatter: Naadjuuh. Kilde: Wikimedia Commons. Det påvirker pusting, fotosyntese og andre metabolske baner for planter som forårsaker forverring. Dens disposisjon i miljøet (verken vann eller jordsmonn eller atmosfære) skal ikke påvirkes).
Farlig tilstedeværelse i noen naturlige midler
Til tross for dens toksisitet er det naturlige midler og urter som inneholder det, slik at folk, uten å vite det, er farlig utsatt for denne forbindelsen.
For eksempel inneholder Calomel eller Qing Fen i tradisjonell kinesisk medisin noe HGCL2. Det er et middel som brukes som vanndrivende, antiseptisk, hud salve, avføringsmiddel og påført eksternt for ubehag i tannbehandling hos barn.
 Noen FN -kontrollerte naturlige medisiner kan inneholde HGCL2. Forfatter: Silvija -vesener. Kilde: Pixabay.
Noen FN -kontrollerte naturlige medisiner kan inneholde HGCL2. Forfatter: Silvija -vesener. Kilde: Pixabay. Referanser
- ELLER.S. National Library of Medicine. (2019). Merkurisk klorid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Lester, s.C. (2010). Prøvebehandling. Zenkers eddikende fiksering (oransje). I Manual of Surgical Pathology (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Clarksson, t.W. (2001). Agenter. Fysiske og kjemiske egenskaper. I Handbook of Peticid Toxicology (Second Edition). Gjenopprettet fra Scientedirect.com.
- Fretham, s.J.B. et al. (2015). Kvikksølv og nevrodegenerasjon. Naturlige midler og urter som inneholder HG. I bioaktive ernæringsmenn og kosttilskudd i nevrogisk og hjernesykdom. Gjenopprettet fra Scientedirect.com.
- Knight, s. et al. (2014). Distribusjon og overflod av vannplanter - menneskelige påvirkninger. Kjemiske polutanter. I referansemodulasjon i jordsystemer og miljøvitenskap. Gjenopprettet fra Scientedirect.com.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- CIAVATTA, L. og Grimaldi, m. (1968). Hydrolyse av kvikksølv (II) klorid, HGCL2. Journal of Inorganic and Nuclear Chemistry, bind 30, utgave 2, februar 1968, side 563-581. Gjenopprettet fra Scientedirect.com.
- Wikimedia Foundation (2020). Kvikksølv (ii) klorid. Innhentet fra.Wikipedia.org.
- « 21 meksikanske forskere og deres historiske bidrag
- Kvikksølvfulminatstruktur, egenskaper, innhenting, bruker »

