Kvikksølvfulminatstruktur, egenskaper, innhenting, bruker
- 2168
- 452
- Magnus Sander Berntsen
Han Kvikksølv fulminat Det er en uorganisk forbindelse dannet av kvikksølvet (Hg), karbon (C), nitrogen (N) og oksygen (O) elementer (O). Den kjemiske formelen er HG (CNO)2. Det skal ikke forveksles med kvikksølv cyanato, for selv om begge forbindelser har de samme elementene, binder atomene i sistnevnte seg annerledes.
Det ble oppdaget av den engelske kjemikeren Edward Howard i 1800. Nesten 200 år før det ved et uhell hadde blitt syntetisert av den tyske Alchemist Johannes Kunkel ved et uhell, som for eksplosjonen ikke isolerte den, men la skriftlige poster over ingrediensene som ble brukt.
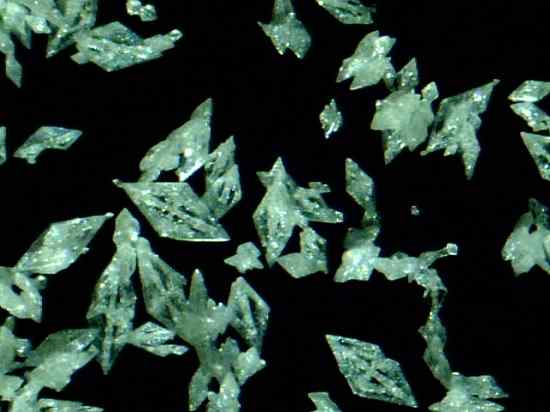
 Mercury Fulminat Crystals Hg (CNO)2. Daniel Grohmann/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Mercury Fulminat Crystals Hg (CNO)2. Daniel Grohmann/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Det er et primært eksplosiv, så det brukes i perkusjon eller sprengningskapsler for å fremme eksplosjonen av andre stoffer. Selv om dens forberedelse og bevaring er ekstremt farlig, ble den mye brukt i det nittende århundre som detonator i krig og jaktvåpen.
Det brukes for tiden til detonasjon av kraftige dynamittbelastninger i konstruksjonen av tunneler og veier og gruvedrift.
Det er helt klart en ekstremt farlig forbindelse som bare kan manipuleres av mennesker med dyp kunnskap om hvordan de skal håndtere eksplosiver.
[TOC]
Struktur
HG (CNO)2 Det er et hcno fulmininsyresalt. Inneholder kvikksølv i oksidasjon +2 og to CNO fulminatenheter-.
I følge en røntgenstudie utført i 2007 i Tyskland (rapportert på engelsk i 2008), har kvikksølv fulminatmolekyler ONC-HG-CNO-strukturen, der det observeres at kvikksølv er direkte knyttet til karbonatomer.
C-HG-C-unionen er lineær; danner en vinkel på 180 ° og Fulminat-gruppen (CNO) har en kort karbon-nitrogenbinding og en lengre nitrogen-oksygenbinding.
Lengden på C-N-koblingen er 1.14-1.17 Å (angstroms), som tilsvarer en trippel svak lenke. N-O-lenken er 1,20-1,25 Å som indikerer en svak dobbeltbinding. En angstrom (Å) er et lengdemål og er den ti -melondelen av en meter.
Det kan tjene deg: metoder for separasjon av homogene blandinger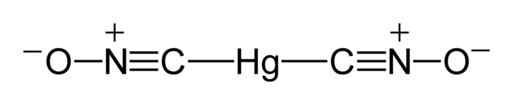 Lewis Structure of Mercury Fulminat. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
Lewis Structure of Mercury Fulminat. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. I fast tilstand Selv om C-Hg-C-unionen er lineær og CNO-gruppen også er, avviker N-C-HG-unionen fra lineariteten i 11 °, det vil si at den har en vinkel på 169 °.
 HG Molecule (CNO)2 I fast tilstand. Grå = kvikksølv; Svart = karbon; blå = nitrogen; Rød = oksygen. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
HG Molecule (CNO)2 I fast tilstand. Grå = kvikksølv; Svart = karbon; blå = nitrogen; Rød = oksygen. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. I henhold til den nevnte studien er imidlertid hele molekylet i gassform helt lineært.
Nomenklatur
- Kvikksølv fulminat
- Mercuric fulminate
- Kvikksølv diffulminere
- Kvikksølv bisfulminat
- Fulmininsyre kvikksølvsalt
- Fulminant kvikksølv
- Eksplosiv kvikksølv
Egenskaper
Fysisk tilstand
Hvitt til oransje fast stoff.
 HG (CNO)2 fuktet faststoff. Daniel Grohmann/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
HG (CNO)2 fuktet faststoff. Daniel Grohmann/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Molekylær vekt
284,63 g/mol
Smeltepunkt
Det smelter ikke. Blir oppvarmet ved mer enn 100 ° C utnyttelse.
Tetthet
4,42 g/cm3
Løselighet
Litt løselig i vann. Løselig i etanol (C2H5Å) og ammoniumhydroksyd (NH4ÅH).
Kjemiske egenskaper
Det er en veldig eksplosiv sammensatt og svært følsom for slag, påvirkninger eller friksjon. Du kan enkelt detonere med gnister og flammer. Når det dekomponerer for form kvikksølvgasser (Hg), karbonmonoksid (CO) og nitrogen (n2).
Med svovelsyre (h2SW4) Konsentrat forekommer også en voldsom detonasjon. Saltsyren løser den delvis og kvikksurisk klorid oppstår.
I følge en studie utført i 1981, hvis den gjennomgår kontrollert og veldig langsom oppvarming, under en inert argonatmosfære, når den når 120 ° C, oppstår en ikke -eksplosiv dekomponering og faste kvikksydoksid og kvikksølvgasser og kvikksølvgasser og oksygengasser dannes.
Det er en forbindelse som har blitt studert av sjeldne tider for dens fare og slike muligheter for studier har blitt veldig distansert fra hverandre i tide. Du må jobbe i mørket for å unngå eksplosjoner. Prøvene hans skal holdes under vann og uten lys.
 HG Solid (CNO)2 Hold under vann. Daniel Grohmann/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
HG Solid (CNO)2 Hold under vann. Daniel Grohmann/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Å skaffe
Etter oppdagelsen var det kommersielt gjennom reaksjonene mellom etanol (CHO3Ch2Å), kvikksølv (HG) og salpetersyre (HNO3).
Det kan tjene deg: Clausius-Clapeyron-ligning: Hva er det for, eksempler, øvelserI en av de viktigste studiene på strukturen til denne forbindelsen, antyder forskere at for å oppnå større ytelse under forberedelsen, må den første halvdelen av det totale volumet av etanol tilsettes HG- og HNO -blandingen3 Før brune gasser forsvinner.
Det er med andre ord viktig at nitrogenoksider er til stede slik at reaksjonen fortsetter.
Det som skjer først er konvertering av etanol til acetaldehyd. I følge visse studier følger mer oksidasjon, nitrering, dekarboksylering og eliminering av lystsyre slik at fulminatet dannes.
Jeg bruker som detonerende middel for andre eksplosiver
Krigssøknader
De første forsøkene på å bruke kvikksølv fulminat som eksplosivt støv for skytevåpen ble frustrert over den ekstraordinære hastigheten og volden i deres detonasjon.
Våpen og haglene ble ødelagt av små belastninger med denne forbindelsen. Det skjedde også med artilleri og granater i militære tester.
I 1822 brukte den engelske Wright den for første gang som brann i sine sportsjaktrifler. Deretter i Bretagne ble bruken av bruken av infanteri implementert og deretter i hele Europa.
 I det nittende århundre ble Mercury's fulminate brukt som detonator av mange typer krigsarmer. Forfatter: Vetsikas Dimitris. Kilde: Pixabay.
I det nittende århundre ble Mercury's fulminate brukt som detonator av mange typer krigsarmer. Forfatter: Vetsikas Dimitris. Kilde: Pixabay. Fram til begynnelsen av 1900 -tallet var det den eneste detonatoren som ble brukt til skyting av prosjektiler av noe slag, inntil andre alternativer med tryggere og tilgjengelige forbindelser ble implementert.
Fredelige applikasjoner
Denne forbindelsen har spilt en viktig rolle i utviklingen av eksplosiver til fredelige formål.
Hans rolle i oppfinnelsen av dynamitt av Alfred Nobel var veldig betydelig. Denne forskeren kombinerte nitroglyserin, et kraftig eksplosiv, med et porøst materiale, jordens jord. Men detonasjonen av denne blandingen er vanskelig med gnister eller veker.
Nobel overskred denne vanskeligheten med å bruke kvikksølv fulminat fulminat -kassetter som var pålitelige i søknaden deres. Denne kombinasjonen tillater for tiden bruk i gruvedrift, utnyttelse av steinbrudd, tunnelbygging og sivilingeniør for veibygging, jernbaner, havner, etc.
Det kan tjene deg: Buteno Det har blitt mye brukt som detonator av eksplosjoner i gruvedrift og veibygging. Forfatter: Nyamdorj. Kilde: Pixabay.
Det har blitt mye brukt som detonator av eksplosjoner i gruvedrift og veibygging. Forfatter: Nyamdorj. Kilde: Pixabay. Alfred Nobel la selv vekt på den grunnleggende viktigheten av kvikksølv fulminat i sivilingeniørutvikling som fremmet dynamitt.
Risiko
Det er en veldig ustabil og ekstremt eksplosiv forbindelse.
 Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay.
Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay. Det gir akutt toksisitet. Det er giftig hvis det blir inntatt, inhalert eller hvis det kommer i kontakt med huden. Produserer enkelt kontaktdermatitt. Det forårsaker skade på indre organer hvis personen blir utsatt repetitivt eller langvarig.
Veldig giftig for vannlevende og terrestrisk liv med kontinuerlig langvarig fare.
Referanser
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- ELLER.S. National Library of Medicine. (2019). Kvikksølv difminerer. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Munroe, ca.OG. (1912). Merk om produksjonen av kvikksølv fulminat. Journal of Industrial & Engineering Chemistry 1912, 4, 2, 152-153. Gjenopprettet fra puber.ACS.org.
- Kurzer, f. (2000). Fulmininsyre i historien til organisk kjemi. J Chem. Utdanning. 2000, 77, 7, 851. Gjenopprettet fra puber.ACS.org.
- Beck, w. og Klapötke, t.M. (2008). Kvikksølv fulminat: ONC-HG-CNO eller CNO-HG-ENC-A DFT-studie. Journal of Molecular Structure: Theochem 848 (2008) 94-97. Gjenopprettet fra Scientedirect.com.
- Wilson, e. (2007). Kvikksølv fulminatet seg. Chemical & Engineering News Archive 2007, 85, 36, 10. Gjenopprettet fra puber.ACS.org.
- Brown, m.OG. og Swallowe, g.M. (1981). Den termiske nedbrytningen av sølv (I) og kvikksølv (II) salter av 5-nitrotetrazol og kvikksølv (II) fulminat. Thermochimica Acta, 49 (1981) 333-349. Gjenopprettet fra Scientedirect.com.
- Alderson, h.OG. (1910). Til ny yrke dermatose. Dermatitt på grunn av tørr fulminat av kvikksølv. Cal State J Med 1910 AP; 8 (4): 114. NCBI kom seg.NLM.NIH.Gov.
- Wikimedia Foundation (2020). Kvikksølv (ii) fulminat. Innhentet fra.Wikipedia.org.
- « Kvikksølvklorid (II) struktur, egenskaper, innhenting, bruk
- Landbrukssivilisasjoner Kjennetegn og bidrag »

