Kjemisk forbindelse
- 2389
- 128
- Magnus Sander Berntsen
Vi forklarer hva kjemiske forbindelser består av, typene som eksisterer, forskjellene med de kjemiske elementene og gir flere eksempler.
 Kjemiske forbindelser er alt det stoffet som har atomer av to forskjellige kjemiske elementer
Kjemiske forbindelser er alt det stoffet som har atomer av to forskjellige kjemiske elementer Hva er en kjemisk forbindelse?
EN kjemisk forbindelse Det er et stoff dannet av foreningen av to eller flere atomer med forskjellige kjemiske elementer. De kjemiske forbindelsene forblir samlet takket være de kjemiske bindingene, som er relatert til elektronene til de koblede atomer; Det vil si i en kjemisk forbindelse som de (ytterste) elektronene i atomene griper inn i dannelsen av koblingene.
Komponentene i kjemiske forbindelser (kjemiske elementer) kan ikke skilles fra hverandre ved fysiske metoder, for eksempel: destillasjon, sentrifugering, filtrering, etc., krever kjemiske metoder på plass for å oppnå det.
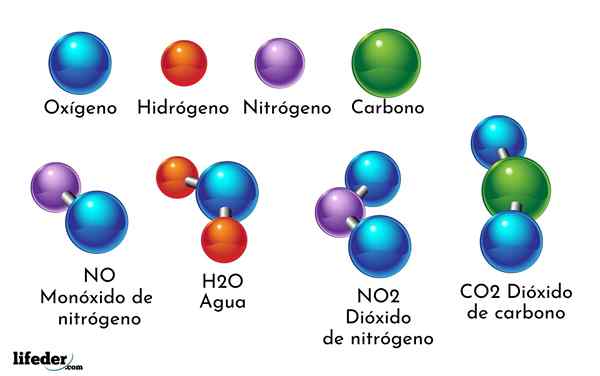
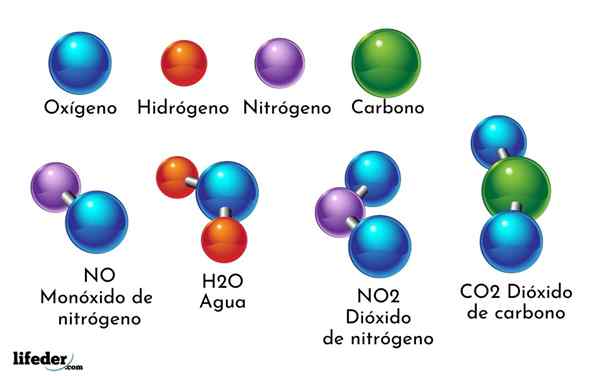
Et eksempel på kjemisk forbindelse er vann. Det dannes bare to atomer av to forskjellige kjemiske elementer: oksygen og hydrogen, med den kjemiske formelen H2ENTEN. Derfor binder to H med en eller for å danne H2ENTEN.
Et kjemisk element, i motsetning til kjemiske forbindelser, er den enkleste og mest grunnleggende måten som utgjør materie. Det presenteres som en unik type atom som ikke kan deles opp i enklere stoffer ved kjemiske reaksjoner.
Typer kjemiske forbindelser
Kjemiske forbindelser kan hovedsakelig klassifiseres etter to kriterier:
- I henhold til typen binding som forener de kjemiske elementene som er til stede i den kjemiske forbindelsen.
- I henhold til sammensetningen og strukturen til den kjemiske forbindelsen.
I henhold til koblingstypen
Avhengig av koblingstypen, kan kjemiske forbindelser være:
- Molekyler. De er kjemiske forbindelser dannet av to eller flere typer forskjellige kjemiske elementer, som er forbundet med en kovalent binding. Denne lenken er preget av deling av ett eller flere par ytre elektroner, eller Valencia, mellom to atomer.
- Ioner. Elektrisk belastede kjemiske forbindelser kalles ionekjemiske forbindelser, og deres ioner er forent av ionisk lenke. Denne bindingen oppstår når du går sammen med et kjemisk element av metalltypen med et ikke -metalt kjemisk element.
- Intermetalliske forbindelser. Det er en type metalllegering som utgjør et solid materiale som er mellom to eller flere metallkjemiske elementer for å holde dem sammen.
- Koordinasjon. De er dannet av et sentralt metallisk element, kalt koordinasjonssenter, og som omgir et sett med forente molekyler eller ioner kjent som ligander. Hemoglobin er for eksempel et protein som finnes i røde blodlegemer og som transporterer oksygen i blodet. Hemoglobin har en koordinasjonsforbindelse som heter Grupo Hemo. I midten av hemoen er det et jernatom som griper inn i transport av oksygen gjennom hemoglobin.
I henhold til komposisjonen og strukturen
I følge dette kriteriet er kjemiske forbindelser klassifisert som organiske og uorganiske.
- Organiske forbindelser. De er forbindelser hvis viktigste kjemiske element er karbon, som vanligvis danner koblinger med atomer med samme karbon og hydrogen. Imidlertid er de også til stede, selv om de i mindre grad, oksygen, nitrogen, svovel, bor, fosfor, etc. Organiske forbindelser kan være:
- Alifatisk. Molekylene til de alifatiske forbindelsene kan ha lineære eller sykliske former, det vil si i lukkede former som trekanter, firkanter, pentagoner, etc. De kan ha karbonbindinger av tre typer: enkle (c-c), dobbel (c = c) eller trippel (C≡C).
- Aromatisk. De er sykliske forbindelser som vekselvis presenterer enkle karbon-karbonbindinger og doble karbon-karbonbindinger.
- Heterocyklisk. De er forbindelser som har en syklisk struktur, som kan presentere erstatning av et karbonatom med et annet kjemisk element (O, S, N, etc.).
- Organometallisk. De er organiske forbindelser som kan presentere i sammensetningen metallelementer.
- Polymerer. De er store molekyler (makromolekyler) som dannes av små og identiske enheter som gjentas i hele polymeren, og som kalles monomerier.
- Uorganiske forbindelser. Uorganiske forbindelser, i motsetning til organiske, har ikke karbon som det sentrale kjemiske elementet, men griper heller i sammensetningen de fleste av de kjente kjemiske elementene. Uorganiske forbindelser kan være:
- Grunnleggende oksider. De dannes ved reaksjon av et metallkjemisk element, for eksempel natrium, kalsium, jern, kobber, etc., Med oksygen. For eksempel er natriumoksid (NAO) et grunnleggende oksid. De kalles grunnleggende oksider fordi de vil gi opphav til basene eller hydroksider.
- Syreoksider. De stammer fra reaksjonen av et ikke -metallisk kjemisk element, for eksempel klor, fluor, svovel, brom, etc., Med oksygen. For eksempel bromoksid (BR2ENTEN5) Det er et syreoksid. De kalles syreoksider fordi de gir opphav til syrer.
- Hydror. De presenterer i sin kjemiske sammensetning tilstedeværelsen av hydrogen. Det er to typer: metalliske hydros og ikke -metalliske hydror.
- Metall. De dannes ved reaksjon av hydrogen, med oksidasjonstilstand -1, med et metall. Disse kjemiske forbindelsene er de eneste der hydrogen er til stede med oksidasjonstilstand -1. For eksempel CAH2 Det er kalsiumhydrid.
- Ikke metallisk. De dannes ved reaksjon av hydrogen, med oksidasjonstilstand + 1, med et ikke -metallisk element med sin lavere oksidasjonstilstand. Klorhydrid (HCl) er en gass som når saltsyre blir oppløst i vann.
- Syrer. De er uorganiske kjemiske forbindelser, selv om det er organiske syrer, som har en pH mindre enn 7 og vender seg til fargen på rødt -til -rød papir til rødt. De kan klassifiseres i hydracycids og oksacids.
- Hydrati. De stammer fra reaksjonen av hydrogen med en ikke -metall for å danne et hydrid som løses opp i vann, stammer fra en syre; For eksempel iarhydronsyre (hei).
- Oxcacids. Det stammer fra reaksjonen av et oksyd av et ikke -metallisk kjemisk element med vann. For eksempel svoveloksydreaksjon (så3) Med vann produserer svovelsyre (h2SW4).
- Du går ut. De er kjemiske forbindelser som stammer fra interaksjon av syre og basiske forbindelser. I sin komposisjon kan det være like mange metallelementer som ikke -metallisk. Salter er klassifisert som:
- Nøytrale salter. De har sin opprinnelse i en reaksjon av nøytralisering mellom en syre og en base med dannelse av salt og vann. For eksempel produserer natriumhydroksydreaksjon (NaOH) med saltsyre (HCl) natriumklorid (NaCl), salt og vann. De kalles nøytrale fordi de ikke produserer en variant av pH.
- Syresalter. De dannes ved reaksjon av et metallhydroksid med Valencia +1, med en syre med flere hydrogener. Reaksjonen av litiumhydroksyd (LIOH) med kullsyre (H2Co3), produserer erstatning av bare ett hydrogen med litium, som forårsaker bikarbonatet til litium (Lihco3), Et syresalt og vann.
- Grunnleggende salter. De produseres ved reaksjonen fra en base som har mer enn en gruppe OH med en hydrati -syre, for eksempel saltsyre. Når du reagerer syre med kalsiumhydroksyd, Ca (OH)2, Et kloratom erstatter en hydroksylgruppe (OH). Dette produserer kalsiumhydroksyklorid (Cuckloh), et grunnleggende salt og vann.
Forskjeller mellom kjemiske forbindelser og kjemiske elementer
 Opp de kjemiske elementene og de kjemiske forbindelsene. Kjemiske forbindelser dannes av elementene ovenfor
Opp de kjemiske elementene og de kjemiske forbindelsene. Kjemiske forbindelser dannes av elementene ovenfor Hvert kjemiske element tilsvarer et spesifikt atom og bare med den typen atom; det vil si at et kjemisk element ikke har forskjellige typer atomer. Atomet er den elementære partikkel av materie som ikke er delt på fysiske eller kjemiske metoder.
Atomet til et kjemisk element kan kobles sammen med atomene til andre kjemiske elementer for å danne kjemiske forbindelser, som kan skilles inn i komponentene deres (kjemiske elementer) ved bruk av kjemiske metoder.
De kjemiske elementene og kjemiske forbindelsene med et puslespill kan utstyres: puslespillene har forskjellige egenskaper, slik at de kan matche de kjemiske elementene.
Puslespillene kan bli med for å danne forskjellige figurer. De dannede figurene kan likestilles med kjemiske forbindelser. Når aktiviteten er ferdig, kan puslespillfigurene skilles inn i brikkene som utgjør den.
Eksempler på kjemiske forbindelser
Nedenfor kan du se en serie eksempler på daglige kjemiske forbindelser:
- HCl: saltsyre
- H2S: Sulfhydrisk syre
- HF: Fluorhydronsyre
- H2SW4: Svovelsyre
- Hclo4: Perklorsyre
- H3Po4: Fosforsyre
- H2Co3: Kullsyre
- Hno3: Salpetersyre
- NaOH: natriumhydroksyd
- CA (OH)2: Kalsiumhydroksid
- Tro (å)2: Jernhydroksyd
- Tro (å)3: Jernhydroksyd
- Nah: natriumhydrid
- Cu2O: Cuprous -oksid
- Cuo: Cupric Oxide
- Tro2ENTEN3: Jernoksid
- Cl2ENTEN7: Perklorisk oksid
- Br2O: Hipobromous oksid
- Yo2ENTEN3: Hypoyodose oksid
- NaCl: natriumklorid
- FECL3: Jernklorid
- HCO3: Natrium bikarbonat
- Ch3Sti: natriumacetat
- Na2SW4: Natriumsulfat
- Feso4: Jernholdig sulfid
- H2O: Vann
- Co2: Karbondioksid
- C6H12ENTEN6: Glukose
- C12H22ENTENelleve: Sukrose
Andre emner av interesse
Kjemiske reaksjoner
Kjemi i hverdagen: eksempler
Organiske forbindelser
Uorganiske forbindelser
Kjemisk forbindelse
Rene stoffer
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2021). Kjemisk forbindelse. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (27. august 2020). Sammensatt definisjon i kjemi. Gjenopprettet fra: Thoughtco.com
- Toppr. (s.F.). Hva er sammensatt i kjemi? Typer kjemisk forbindelse. Gjenopprettet fra: Toppr.com

