Binære forbindelsesdannelse, typer, eksempler, nomenklatur
- 4347
- 1387
- Jonathan Moe
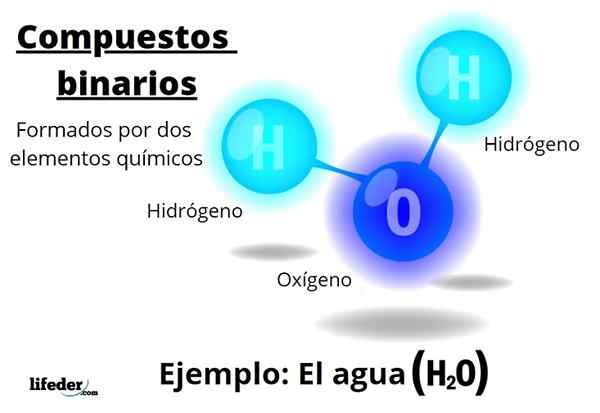
De binære forbindelser De er alle dannet av to kjemiske elementer, uavhengig av antall atomer eller deres interaksjoner. Den generelle formelen for disse forbindelsene ernBm, hvor a og b er to forskjellige elementer i det periodiske tabellen, og n og m deres respektive støkiometriske koeffisienter.
For eksempel vann, h2Eller det er en binær forbindelse, som kanskje er den mest representative for dem. Vann består av hydrogen, H og oksygen, eller dermed tilsetter to kjemiske elementer. Merk at dens støkiometriske koeffisienter indikerer at det er to hydrogen- og ett oksygenatomer, men det er fremdeles en binær forbindelse.

Binære forbindelser kan bestå av ioner, molekyler, tre -dimensjonale nettverk eller til og med nøytrale metallatomer. Det viktige er at uansett hva den kjemiske bindingen eller dens sammensetning alltid dannes av to forskjellige kjemiske elementer. For eksempel hydrogengass, h2, teller ikke som binær forbindelse.
Binære forbindelser ser kanskje ikke ut til å begynne med så rik og kompleks sammenlignet med ternære eller kvartære forbindelser. Imidlertid er blant dem mange viktige stoffer for terrestriske økosystemer, som salter, oksider, sulfider og noen gasser med enorm biologisk og industriell verdi.
[TOC]
Hvordan er binære forbindelser?
Forberedelsesmetoder eller syntetiske ruter for å danne binære forbindelser vil avhenge av identiteten til de to kjemiske elementene A og B. I prinsippet og generelt må begge elementene kombineres i en reaktor slik at de kan samhandle med hverandre. Således, hvis forholdene er gunstige, vil en kjemisk reaksjon finne sted.
Å ha en kjemisk reaksjon, elementer A og B vil bli med eller koble (ionisk eller kovalent) for å danne forbindelsen tilnBm. Mange binære forbindelser kan dannes ved direkte kombinasjon av deres to rene elementer, eller følge andre mer økonomisk levedyktige alternative metoder.
Det kan tjene deg: sinkoksid (ZnO): struktur, egenskaper, bruksområder, risikoTilbake til eksemplet med vann, hydrogen, h2, og oksygen, eller2, De kombineres ved høye temperaturer slik at det er en forbrenningsreaksjon mellom dem:
2H2(g) + eller2(g) → 2H2O (g)
Vann kan derimot oppnås gjennom dehydreringsreaksjoner av forbindelser som alkoholer og sukkerarter.
Et annet eksempel på dannelse av en binær forbindelse tilsvarer jernholdig sulfid, FES:
Tro (er) + s (s) → FeS (S)
Der denne gangen er både jern og svovel faste og ikke brus stoffer. Og dette er det samme med flere binære salter, for eksempel natriumklorid, NaCl, som kombinerer metallisk natrium med klorgasser:
2na (S) + CL2(g) → 2NaCl (S)
Nomenklatur
Navnene på alle binære forbindelser styres stort sett av de samme reglene.
For forbindelsen tilnBm, Navnet B nevnes først i sin anioniske form; det vil si med slutten. I tilfelle at B består av oksygen, er det imidlertid kalt et oksid, peroksyd eller superoksyd som påført.
Navnet på B er gitt av gresk tallprefikser (mono, di, tri, tetra, etc.) i henhold til verdien av m.
Til slutt nevnes navnet A. I tilfelle at den har mer enn en valens, er det indikert med romertall og i parenteser. Eller hvis du er foretrukket, kan du velge den tradisjonelle nomenklaturen og bruke suffikser -ooso e -ico. Element A noen ganger er også gitt av greske tallprefikser i henhold til verdien av n.
Tenk på følgende binære forbindelser sammen med deres respektive navn:
-H2O: Hydrogenoksid eller dihydrogenmonoksid (dette etternavnet er en årsak til erting)
-FES: Jernsulfid (II) eller jernholdig sulfid
-NaCl: natriumklorid eller natriumklorid
Kan servere deg: olje eller benzineeter: formel, struktur, bruk-Mgcl2: magnesiumklorid, magnetisk klorid eller magnesiumdiklorid
Merk at det ikke sies 'monosodiumklorid' eller 'monohierro sulfid'.
Typer: Klassifisering av binære forbindelser
Binære forbindelser er klassifisert i henhold til hva som er dannet eller fakta: ioner, molekyler, metallatomer eller nettverk. Likevel er denne klassifiseringen ikke helt avgjørende eller definitiv, og kan variere avhengig av tilnærmingen som vurderes.
Ionisk
I ioniske binære forbindelser består A og B av ioner. Dermed for forbindelsen tilnBm, B er vanligvis en anion, B-, Mens en kation, til+. For eksempel tilhører NaCl denne klassifiseringen, så vel som alle binære salter, hvis generelle formler er bedre representert som MX, der X er en anion, og M A Metallic kation.
Dermed fluorider, klorider, bromuros, jodid., De tilhører også denne klassifiseringen. Det skal imidlertid bemerkes at noen av dem er kovalente, og tilhører derfor følgende klassifisering.
Kovalent
Kovalente binære forbindelser dannes av molekyler. Vannet tilhører denne klassifiseringen, ettersom det består av H-O-H-molekyler. Hydrogenklorid, HCl, regnes også som en kovalent binær forbindelse, siden det består av H-CL-molekyler. Merk at NaCl er ionisk, mens HCl er kovalent, begge klorider er.
Metalliske eller nettverk
Binære forbindelser dekker også legeringer og faste stoffer i tre -dimensjonale nettverk. For dem brukes imidlertid betegnelsen av binære materialer vanligvis bedre.
For eksempel regnes messing, mer enn en forbindelse, som et binært materiale eller legering, siden det er dannet av kobber og sink, Cu-Zn. Merk at det ikke er skrevet ved ikke å ha definert støkiometriske koeffisienter.
På samme måte er det silisiumdioksid, Sio2, dannet av silisium og oksygen. Atomene deres er koblet ved å definere et tre -dimensjonalt nettverk, der du ikke kan snakke om molekyler eller ioner. Mange nitrider, fosfon og karbider, når de ikke er ioniske, handler også om denne typen nettverk.
Kan tjene deg: fenoksyeddiksyre: syntese, prosedyre, bruk, risikoEksempler på binære forbindelser
 Vann er et eksempel på en binær forbindelse
Vann er et eksempel på en binær forbindelse Det vil bli oppført for å fullføre flere binære forbindelser ledsaget av deres respektive navn:
-Libr: litiumbromid
-Cacl2: kalsiumklorid
-FECL3: jernklorid (III) eller jernklorid
-Nao: natriumoksid
-Beh2: berylliumhydrid
-Co2: karbondioksid
-NH3: Nitrogen eller ammoniakk trihydrid
-BNP2: Bly jodid (ii) eller bly diyoduro
-Mg3N2: Magnesiumnitruro
-Til2ENTEN3: Aluminiumoksyd eller diauminium trioksid
-Na3Spørsmål: Natriumfosfuro
-Alf3: Aluminiumfluorid
-Racl2: radioklorid eller radiodiklorid
-Bf3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-WC: Tungsten -karbid eller Wolframium
Hvert av disse eksemplene kan ha mer enn ett navn om gangen. Av disse, CO2 Det har stor innvirkning på naturen, ettersom den brukes av planter i prosessen med fotosyntese.
På den annen side, NH3 Det er et av stoffene med den mest industrielle verdien, nødvendig for syntese av polymer og organisk syntese. Og til slutt er WC et av de tøffeste materialene som noen gang er opprettet.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Artem Cheprasov. (2020). Hva er en binær forbindelse? - Definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com
- Helmestine, Anne Marie, PH.D. (11. februar 2020). Definisjon av binær forbindelse. Gjenopprettet fra: Thoughtco.com
- Byju's. (2020). Hva er binære forbindelser? Gjenopprettet fra: Byjus.com
- Chemteam. (s.F.). Binære forbindelser av metaller med faste ladninger. Gjenopprettet fra: Chemteam.Info
- Wikipedia. (2020). Binær fase. Hentet fra: i.Wikipedia.org
- « Nitritesegenskaper, struktur, nomenklatur, trening
- Reaksjonsflokkulering, typer, applikasjoner, eksempler »

