Nitritesegenskaper, struktur, nomenklatur, trening
- 1372
- 71
- Prof. Oskar Aas
De nitritter De er alle de forbindelsene som ikke inneholder anion2-, Hvis de er uorganiske, eller gruppen -ono, hvis de er organiske. De aller fleste er metallnitritter, som er uorganiske salter der ingen2- samhandle elektrostatisk med c -kationern+; For eksempel natriumkation, Na+.
Dermed natriumnitritt, nano2, Det er et eksempel på en salt- eller nitrittforbindelse. Disse saltene finnes i naturen, enten i jord, hav, pattedyr og plantevev, ettersom de er en del av den biologiske syklusen av nitrogen. Derfor nei2- Det er et stoff som er til stede i våre organismer, og er knyttet til vasodilatorprosesser.
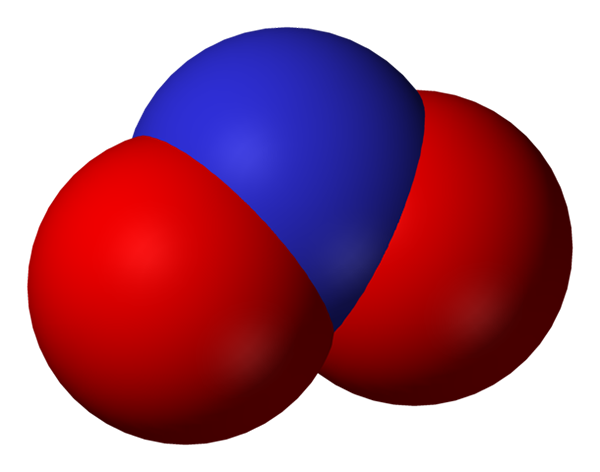
 Plass full av nitrittanion. Kilde: Benjah-BMM27.
Plass full av nitrittanion. Kilde: Benjah-BMM27. Nitritt blir en mindre form av nitrogen, eller mindre oksidert, enn nitrat, ikke3-. Nitrogenoksid oppstår fra det, ingen i regioner av organismen der det er oksygenmangel. Han er ikke et signalmolekyl som utøver en vasodilatoreffekt ved å slappe av muskler og arterier.
Av biokjemi og medisin brukes nitritter som bakterikere, og er deres aggregering for ganske vanlig kjøtt. Dette med det formål å kurere dem og utvide kvaliteten og friskheten lenger.
Nitritt har to ansikter: en som er gunstig for helse, og en annen som setter den i fare. Det gode ansiktet skyldes nettopp reaksjonene som reduserer det til ikke. I mellomtiden skyldes det dårlige ansiktet det.
[TOC]
Nitritesegenskaper
Grunnleggende
Nitritter er grunnleggende salter, fordi anion ikke gjør det2- Det er den konjugerte basen til lystallsyre, HNO2:
Hno2 + H2Eller ⇌ nei2- + H3ENTEN+
I vann og i noen få mengder er det hydrolysert for å opprinnelig OH -ioner-:
NEI2- + H2Eller ⇌ hno2 + Åh-
Denne basaliteten er iboende for alle nitritsalter, siden den ikke er avhengig av ikke2- og ikke av kationene som følger ham. Imidlertid disse kationene og deres interaksjon med nei2- De påvirker løseligheten av nitrittsalter i vann og andre polare løsningsmidler.
Reaksjoner
Nitritesreaksjoner varierer avhengig av hvilke kationer som følger med nei2-, eller om det er en organisk nitritt, rono. Generelt sett kan nitritter dekomponere, oksidere eller redusere til: metalloksider, ikke3-, NEI2, Nei, og til og med nitrogengass, n2.
Kan tjene deg: Termodynamiske prosesserFor eksempel ammoniumnitritt, NH4NEI2 kan dekomponere til n2 og h2ENTEN.
Fysiske opptredener
Nesten alle nitritter er faste stoffer med krystallinsk utseende. Mange er hvite eller gulaktige farger, selv om det er fargerike hvis de inneholder overgangsmetaller kationer.
På den annen side er for det meste organiske nitritter svært ustabile og eksplosive flyktige væsker.
Struktur
Nitrittanion
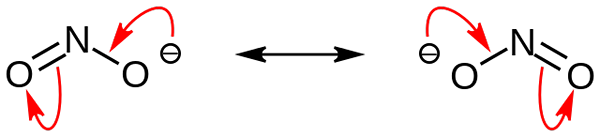 Nitrittanionresonansstrukturer. Kilde: Nohingserius / Pub Domain
Nitrittanionresonansstrukturer. Kilde: Nohingserius / Pub Domain I det første bildet ble nitrittanionen vist med en full rommodell. Denne modellen har ulempen som er nøyaktig den samme som nitrogendioksid, nei2. På den annen side beskriver det overlegne bildet nitrittanionen bedre og hvordan dens negative belastning oppfører seg.
Denne belastningen flyttes mellom de to oksygenatomene, så hver og en har halvparten av nevnte negativ belastning (-1/2). Og det er denne negative belastningen som er ansvarlig for å tiltrekke seg omkringliggende kationer på grunn av enkel elektrostatisk tiltrekning.
Faste stoffer
Uorganiske nitritter er alle krystallinske faste forbindelser. Dets interaksjoner er rent elektrostatisk, og har en attraksjon mellom nei2- og kationer mn+. Dermed for eksempel nano2 Den har en ortorrombisk krystallinsk struktur, og dannes av NA -ioner+ og ikke2-.
Den typen krystallinsk struktur vil avhenge av identiteten til m+n, Så ikke alle nitritter deler en ortorrombisk struktur.
Organiske nitritter
Organiske nitritter, i motsetning til uorganiske, er ikke ioniske forbindelser, men kovalente. De er derfor dannet av molekyler, som er preget av å ha en R-Aon-kobling, der R kan være en alkyl eller aromatisk gruppe.
De anses som lystgallesyreestere, ettersom deres hydrogen, H-Don, erstattes av en R-gruppe:
 Generell formel for en organisk nitritt. Kilde: PNGBOT via Wikipedia.
Generell formel for en organisk nitritt. Kilde: PNGBOT via Wikipedia. I følge det overordnede bildet kan denne esteren skrives som rom = o, veldig lik formelen til karbonestere, roc = o. Legg merke til den store likheten som denne strukturen har med nitroforbindelsene, RNO2, Hvor nå er hovedkoblingen R-No2 Og ikke R-Dono. Den eneste forskjellen ligger derfor i atomet det blir med2 til gruppe r.
Det er av denne grunn at nitrittestere og nitroforbindelser regnes som koblingsisomerer, ettersom de har de samme atomene, men koblet annerledes.
Kompleks
Nitrittkomplekser kan ha både uorganiske og organiske komponenter. De danner en koordinasjonsforbindelse mellom et metallsenter og en av ingen oksygen2-. Det vil si at det ikke er noen snakk om en rent elektrostatisk interaksjon, mn+NEI2-, men av koordinering mn+-ELLER IKKE-.
Kan tjene deg: Hva er de fysiske egenskapene til materie?Organiske nitritter og deres komplekser vil etablere eller ikke krystallinske strukturer avhengig av om interaksjonene deres klarer å sette partiklene sine i verdensrommet.
Nomenklatur
Uorganiske og organiske nitritter deler en betydelig enkel nomenklatur. For å nevne dem, er ordene 'nitritt av', etterfulgt av navnet på metallet og dets valens skrevet i parenteser først plassert. På samme måte kan avslutningen -co og -so i tilfelle det er mer enn en Valencia kan brukes.
For eksempel Cuno2 kan navngis på to måter: kobbernitritt (i), eller cuprous nitritt.
Denne nomenklaturregelen gjelder også for organiske nitritter. For eksempel Cho3Ono kalles methilo nitrito, fordi CH3 tilsvarer gruppe R koblet til ingen oksygen2.
Nomenklaturen kan bli komplisert hvis det er andre grupper med lik eller større kjemisk relevans enn nei2, eller hvis de er metallkomplekser.
Opplæring
Nitrifisering
Mange uorganiske nitritter er dannet i naturen i et av trinnene i nitrogensyklusen: nitrifisering. Denne prosessen består av oksidasjon av ammoniakk utført av mikroorganismer, spesielt av nitrosomonas -bakterier.
Nitrifisering dekker også den påfølgende oksidasjon av nitrat til nitrat; Imidlertid er nitrittdannelse det langsomme trinnet i disse reaksjonene, ettersom det krever større energi og må overvinne en større kinetisk barriere.
Følgende ligning eksemplifiserer den nylig utsatte:
2nh4+ + 32 → 2no2- + 4H+ + 2H2ENTEN
Flere enzymer deltar i denne reaksjonen og hydroksylamin produseres, NH2Å, som er produktet som nitrittanioner endelig kommer fra.
Det er takket være nitrifiseringen at planter inneholder nitritter, og på sin side dyrene som konsumerer dem. Nitritter er ikke bare til stede i jorden, men også i havene, og nesten all deres naturlige produksjon skyldes den oksidative og anaerobe virkningen av forskjellige mikroorganismer.
Nitrogenoksider i grunnleggende medier
Nitrittene av alkaliske metaller kan tilberedes industrielt ved å bobbende nitrogenoksider i basiske løsninger eller medier, enten fra deres respektive hydroksider eller karbonater. For eksempel oppstår natriumnitritt i henhold til følgende reaksjon:
Nei +nei2 + NaOH → 2nano2 + H2ENTEN
Når det gjelder ammoniumnitritt, er dyitrogentrioksid boblet i ammoniakk:
Kan tjene deg: Rodio: Historie, egenskaper, struktur, bruk, risiko2nh3 + H2Eller +n2ENTEN3 → 2NH4NEI2
Reaksjon med nitrogenoksid
Alquilico -nitritter, Rono, kan syntetiseres ved React. Den generelle reaksjonen ville være følgende:
R-OH → R-Aon
Nitritesapplikasjon
Kjøtt herding
 Den rødlige fargen på kjøttet skyldes dens kur med nitratsalter og nitrat. Kilde: Pxhere.
Den rødlige fargen på kjøttet skyldes dens kur med nitratsalter og nitrat. Kilde: Pxhere. Nitritter har antibakterielle effekter, så de blir tilsatt i moderate mengder til kjøtt for å bremse rotta. I tillegg til å oppfylle denne funksjonen, reagerer de med kjøttproteiner for å gi dem en mer rødlig og attraktiv farge.
Den dårlige siden av denne praksisen er at noe kjøtt kan ha for mange nitritsalter, og når de koker dem ved høye temperaturer, forvandles de til nitrosoaminas. Derfor er det en risiko for å øke sjansene for å få en slags kreft, hvis forbruket av disse herdede kjøttene er overdreven.
Rod fargestoffer
Nitritter brukes i organisk kjemi for å utføre diazotasjonsreaksjonen, som fargelegging eller fargestoffer er syntetisert.
Pigmenter
Noen nitrittkomplekser, for eksempel kobolt, kan brukes som pigmenter for malerier eller porselen på grunn av deres slående fargestoffer.
Vasodilator
Nitritter er ansvarlige for å generere nitrogenoksid i kroppen i mangelfulle oksygenregioner. Han er ikke et signalmolekyl, som reagerer på blodkar som slapper av og utvides. Denne utvidelsen eller utvidelsen har som en konsekvens av at blodtrykket avtar.
Eksempler på nitritter
Til slutt vil noen eksempler på nitritter være oppført med sine respektive formler og navn:
-Eldre bror2: natriumnitritt
-Kno2: Kaliumnitritt
-MG (nei2)2: Magnesiumnitritt
-Tut2)2: kalsiumnitritt
-Ch3Ch2Ono: Ethylnitritt
-NH4NEI2: ammoniumnitritt
-Zn (nei2)2: sinknitritt
-PB (nei2)2: Blynitritt (ii) eller plumbose nitritt
-Tro (nei2)3: Jernnitritt (iii) eller jernnitritt
-(Ch3)2Chch2Ch2Ono: Isoamilo nitrito
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Nitritt. Hentet fra: i.Wikipedia.org
- Elsevier f.V. (2020). Nitritt. Scientedirect. Hentet fra: Scientedirect.com
- Alfa Aesar. (2020). Nitritsalter. Themo Fisher Scientific. Gjenopprettet fra: Alfa.com
- Redaktørene av Enyclopaedia Britannica. (23. februar 2018). Nitritter. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Anthony r. Butler & Martin Feelisch. (22. april 2018). Terapeutisk bruk av uorganisk nitritt og nitrat. gjør jeg.org/10.1161/Circulationaha.107.753814
- Kris Gunnars. (10. februar 2020). Er nitrater og nitritter i matvarer skadelig? Gjenopprettet fra: Healthline.com
- « Sosial atferdsteori, typer, normer, eksempler
- Binære forbindelsesdannelse, typer, eksempler, nomenklatur »

